
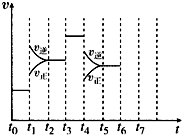
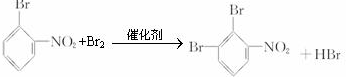
 ��һ�ܱ������з�����ӦN2+3H2?2NH3���ﵽƽ���ֻ�ı�ijһ������ʱ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��
��һ�ܱ������з�����ӦN2+3H2?2NH3���ﵽƽ���ֻ�ı�ijһ������ʱ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ������ ��1������ͼʾ���v��=v�����ж��Ƿ���ƽ��״̬��
��2����ͼ��֪��t1���淴Ӧ���ʾ��������淴Ӧ���ʴ�������Ӧ���ʣ�t3ʱ���淴Ӧ���ʾ����ӣ����淴Ӧ���ʵ�������Ӧ���ʣ�t4ʱ���淴Ӧ���ʾ���С�����淴Ӧ���ʴ�������Ӧ���ʣ�
��3����ͼ��֪��t1ƽ�������ƶ���t3���ƶ��������ƶ����������
��4���跴Ӧǰ����a mol N2��b mol H2����ƽ��ʱ����2x mol NH3����������ʽ�Ͱ���������������㣮
��� �⣺��1������ͼʾ��֪��t0��t1��t2��t3��t3��t4��t5��t6ʱ����ڣ�v����v����ȣ���Ӧ����ƽ��״̬���ʴ�Ϊ��ACDF��
��2����N2��g��+3H2��g��?2NH3��g����H��0����֪���÷�ӦΪ���ȷ�Ӧ����Ϊ���������С�ķ�Ӧ������ͼ��֪��t1���淴Ӧ���ʾ��������淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ�����¶ȣ�t3ʱ���淴Ӧ���ʾ��������淴Ӧ���ʵ�������Ӧ���ʣ��ı�����ӦΪ�Ӵ�����
�ʴ�Ϊ��C��E��
��3����ͼ��֪��t1ƽ�������ƶ���t3���ƶ���t4ƽ�������ƶ�����ʹ�����ĺ������٣���t0��t1�����ĺ������
�ʴ�Ϊ��A��
��4���跴Ӧǰ����a mol N2��b mol H2����ƽ��ʱ����2x mol NH3��
N2��g��+3H2��g��?2NH3��g��
��ʼ a b 0
ת�� x 3x 2x
ƽ�� a-x b-3x 2x
��Ӧ�������ܵ����ʵ���=��a+b-2x��mol��$\frac{2x}{a+b-2x}$=0.2����ã�a+b=12x���ʷ�Ӧ���뷴Ӧǰ�Ļ���������֮��=$\frac{a+b-2x}{a+b}$=$\frac{12x-2x}{12x}$=$\frac{5}{6}$��
�ʴ�Ϊ��5��6��
���� ���⿼��Ӱ�컯ѧ��Ӧ���ʵ����أ�ע����շ�Ӧ���ص㼰ͼ������ǽ��Ĺؼ�����ȷ�¶ȡ�ѹǿ�������Է�Ӧ���ʵ�Ӱ�켴�ɽ����Ŀ�ѶȲ���


 �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д� �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ԫ�ر��ĵ��ʿ�����ұ������ | |
| B�� | ���⻯��ȶ����⻯�����ȶ���ǿ | |
| C�� | �����Ӱ뾶���ң������� | |
| D�� | �����ҵ����������ǿ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Co2O3 | B�� | Co3O3 | C�� | Co3O4 | D�� | Co5O7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
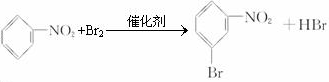 ��
��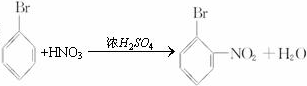 ��
��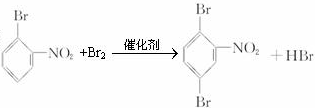 ��
�� ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2CO3��s�� | B�� | ˮ | C�� | �������Һ | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
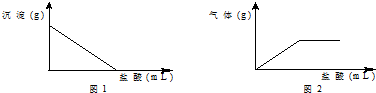 ��һ����ɫ���壬���ܺ���Na2SO4��Na2CO3��BaCl2��NaOH�е�һ�ֻ��֣����и���ʵ����ʵ�ó��Ľ�����ȷ���ǣ�������
��һ����ɫ���壬���ܺ���Na2SO4��Na2CO3��BaCl2��NaOH�е�һ�ֻ��֣����и���ʵ����ʵ�ó��Ľ�����ȷ���ǣ�������| A�� | ȡ������ˮ���а�ɫ����������˵��ԭ��ɫ������һ����Na2SO4��BaCl2 | |
| B�� | ȡ������ˮ�����ú����ϲ���Һ��pH��7��˵��ԭ��ɫ������һ����NaOH | |
| C�� | ȡ������ˮ���а�ɫ�������������˺�������еμ����ᣬ���������������������Ĺ�ϵ��ͼ1��ʾ����ԭ��ɫ��������Na2SO4 | |
| D�� | ȡ������ˮ���а�ɫ�������������˺�������еμ����ᣬ������������������������Ĺ�ϵ��ͼ2��ʾ����ð�ɫ��������NaOH |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com