
| A. | 铁跟氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| B. | 氨水跟盐酸反应:OH-+H+→H2O | |
| C. | 氢氧化钡跟稀硫酸反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O | |
| D. | 碳酸钙跟盐酸反应:CO32-+2H+→CO2↑+H2O |
分析 A.反应生成氯化亚铁,电子、电荷守恒;
B.一水合氨在离子反应中保留化学式;
C.不符合离子的配比;
D.碳酸钙在离子反应中保留化学式.
解答 解:A.铁跟氯化铁溶液反应的离子反应为Fe+2Fe3+=3Fe2+,故A正确;
B.氨水跟盐酸反应的离子反应为NH3.H2O+H+→H2O+NH4+,故B错误;
C.氢氧化钡跟稀硫酸反应的离子反应为Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O,故C错误;
D.碳酸钙跟盐酸反应的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,综合性较强,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同素异形体 | ||
| C. | 15N与14N互为同位素 | D. | 15N和14N的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将木炭粉碎成粉末状可以加快化学反应速率 | |
| B. | 升高温度可以加快化学反应速率 | |
| C. | 增加压强可以加快化学反应速率 | |
| D. | 增加木炭的量可以加快化学反应速 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热才能发生的反应一定是吸热反应 | |
| B. | 断开化学键的过程会吸收能量 | |
| C. | 化学能不仅可以与热能相互转化,还可以与电能相互转化 | |
| D. | 燃烧可能为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
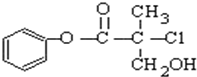
| A. | l mo1 A和足量的H2发生加成反应,最多可以消耗3 mol H2 | |
| B. | 有机物A可以和Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | l mo1 A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
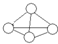 白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )| A. | 4NA | B. | NA | C. | 1.5NA | D. | 0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com