
| A. | C3H8O | B. | C4H10O | C. | C4H8Cl2 | D. | C5H11Cl |
分析 A、C3H8O属于醇或醚,据此进行解答;
B、C4H10O属于醇或醚,据此进行解答;
C、二氯代物的同分异构体可以采用“定一议二”解答;
D、C5H11Cl相当于戊烷中的1个H被Cl取代后生成的产物,戊烷中有几种H就有几种同分异构体.
解答 解:A、C3H8O的同分异构体有3种:1-丙醇、2-丙醇、甲乙醚;
B、分子式为C4H10O的同分异构体有7种: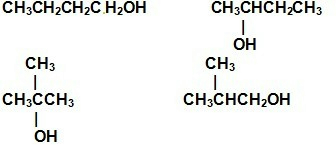 、CH3OCH2CH2CH3、CH3OCCH(CH3)2、CH3CH2OCH2CH3;
、CH3OCH2CH2CH3、CH3OCCH(CH3)2、CH3CH2OCH2CH3;
C、C4H8Cl2的同分异构体可以采取“定一议二”法确定: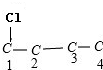
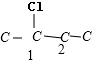
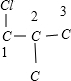 ,故C4H2Cl8共有9种;
,故C4H2Cl8共有9种;
D、戊烷有3种,分别是正戊烷、异戊烷和新戊烷,正戊烷中含有3种化学环境不同的H,异戊烷中含有4种化学环境不同的H,新戊烷中含有1种化学环境不同的H,故C5H11Cl的同分异构体总共有3+4+1=8种;
故最多的是C,故选C.
点评 本题考查同分异构体的书写,难度中等,注意类别异构这一知识点,此外一元取代同分异构体利用等效氢进行的判断是关键.


科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3和Al3+ | B. | Al3+、Al(OH)3 和AlO2- | ||
| C. | Al(OH)3 | D. | 全部为AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6、C4H8 | B. | C2H6、C3H6 | C. | CH4、C4H8 | D. | CH4、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠溶于水:Na+H2O═Na++OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量氨水:Al3++4OH-═[Al(OH)4]- | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O→H2CO3 | B. | H2+I2→HI | C. | NH3+HCl→NH4Cl | D. | SO2+O2→SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的综合利用主要是煤的干馏、液化和气化,气化是指:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | |
| B. | 高温结构陶瓷氮化硅(Si3N4),属于新型无机非金属材料,可用于制造汽车发动机 | |
| C. | 用铝质铆钉来焊接铁板,铁板易被腐蚀 | |
| D. | 用铜、稀硫酸、过氧化氢混合制硫酸铜法体现了“绿色化学”的思想 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同体积、同浓度的NaF和NaCl溶液中,所有离子总数,N(NaCl)>N(NaF);同体积同浓度的Na2CO3和Na2SO4溶液中,所有离子总数,N(Na2CO3)>N(Na2SO4) | |||||||||||
| B. | 以下是某温度下高氯酸、硫酸、硝酸和盐酸在冰醋酸中的电离常数,则在冰醋酸中硫酸的电离方程式可表示为H2SO4?2H++SO42-
| |||||||||||
| C. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] | |||||||||||
| D. | 平衡体系CaCO3(s)?CaO(s)+CO2中仅含有碳酸钙、氧化钙及二氧化碳气体.某时刻,保持温度不变,将容器体积缩小为原来的一半并保持不变,则二氧化碳浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
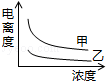 B.
B. C.
C.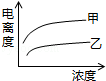 D.
D.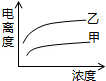
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com