
【题目】常温下,Ksp[Mg(OH)2]=1.1×10-11, Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述不正确的是( )
A. 浓度均为2×10-5mol/L的AgNO3溶液和NaCl溶液等体积混合,有白色沉淀生成
B. 将0.001mol/L的AgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CrO4混合溶液中,先产生AgCl沉淀
C. c(Mg2+)为0.11mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上
D. 其他条件不变时,向饱和Ag2CrO4水溶液中加入少量K2CrO4固体,溶液中c(Ag+)减少
【答案】A
【解析】A.Qc=c(Ag+)c(Cl-)=1×10-10<Ksp(AgCl)=1.8×10-10,没有氯化银生成,故A不正确;B. 浓度均为0.001mol/L的KCl和K2CrO4混合溶液中滴加AgNO3溶液,开始产生AgCl、Ag2CrO4时c(Ag+)分别是 =1.8×10-7mol/L,(
=1.8×10-7mol/L,(![]() =(1.9×10-9
=(1.9×10-9![]() mol/L,AgCl需要的c(Ag+)较小,所以AgCl先析出,故B正确;C. c(OH-)>(
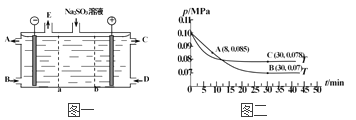
mol/L,AgCl需要的c(Ag+)较小,所以AgCl先析出,故B正确;C. c(OH-)>( 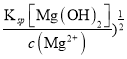 =1×10-5mol/L,溶液的pH要控制在9以上,故C正确;D. 其他条件不变时,向饱和Ag2CrO4水溶液中加入少量K2CrO4固体,溶度积不变,c(CrO42-)增大,c(Ag+)减少,故D正确。故选A。
=1×10-5mol/L,溶液的pH要控制在9以上,故C正确;D. 其他条件不变时,向饱和Ag2CrO4水溶液中加入少量K2CrO4固体,溶度积不变,c(CrO42-)增大,c(Ag+)减少,故D正确。故选A。


科目:高中化学 来源: 题型:
【题目】“雾霾”成为人们越来越关心的环境问题。雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质。请回答下列问题:
(1)汽车尾气是雾霾形成的原因之一。尾气治理可用汽油中挥发出来的烃类物质(CxHy)催化还原尾气中的NO气体,该过程的化学方程式为___________________。
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180.5 kJ·mol-1
2NO(g) ΔH1=+180.5 kJ·mol-1
②2CO(g)![]() 2C(s)+O2(g) ΔH2=+221 kJ·mol-1
2C(s)+O2(g) ΔH2=+221 kJ·mol-1
③C(s)+O2(g)![]() CO2(g) ΔH3=-393.5 kJ·mol-1
CO2(g) ΔH3=-393.5 kJ·mol-1
则ΔH=_____________。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
①a表示_____离子交换膜(填“阴”或“阳”)。A~E分别代表生产中的原料或产品,其中C为硫酸,则A表示_________,E表示___________。
②阳极的电极反应式为___________________________。
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为____________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)______vA(逆)(填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,根据元素在周期表中的位置回答下列问题,
① | ② | ③ | |||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
⑦ | ⑧ | ⑨ | |||||||||||||||
⑩ | |||||||||||||||||
(1)元素⑤在周期表中的位置描述为____________,元素⑧的元素符号__________________。
(2)元素①~⑩的最高价氧化物的水化物中,碱性最强的是________________(填化学式)。
(3)元素②的单质的电子式______________,元素②的简单氢化物与其最高价氧化物的水化物反应,生成物中含有的化学键________________(填“离子键”、“极性键”或“非极性键”),元素①、②、③的简单氢化物的沸点由高到低的顺序是___________________(用化学式表示)。
(4)非金属性比较
a.装置1可用于比较元素①、②、⑤的非金属性强弱,则B中发生反应的离子方程式为:_______。
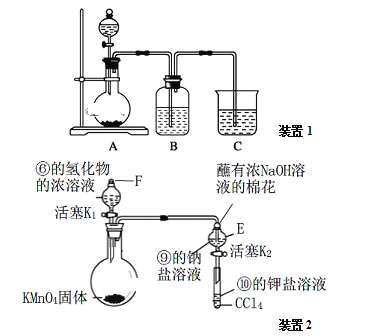
b.打开装置2中玻璃塞F和活塞K1,使液体滴入烧瓶中,待E中溶液颜色不再变化后,打开活塞K2,将E中溶液滴入小试管中,关闭活塞K2,取下小试管振荡,静置,下层液体呈现紫红色。上述实验_______(填“能”或“不能”)证明非金属性⑥>⑨>⑩。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀碳酸钙主要用于食品、医药等行业。以精选石灰石(含有少量MgCO3、FeCO3杂质)为原料制备沉淀碳酸钙的工艺流程如下:

(1)流程中可以循环利用的物质有气体Ⅰ、气体Ⅱ和__________(填化学式)。
(2)“碳化”时发生反应的离子方程式为________________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________________。
(3)工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:

①电解过程中,加入氯化钙的目的是________________。
②石墨电极发生的电极反应方程式为________________。
③电解得到的Na中约含1%的Ca,除去其中少量Ca的方法为________________。
已知部分物质的熔沸点如下表:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )

A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,在某含有Fe3+和Cu2+的溶液中,c(Fe3+)为4.0×10-8mol·L-1现向该溶液中滴加氨水,当开始出现氢氧化铁沉淀时,溶液的pH及溶液中允许的最大c(Cu2+)为
A. 10 2.2 mol·L-1 B. 4 2.2×10-1 mol·L-1
C. 4 2.2 mol·L-1 D. 10 2.2×10-1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com