
【题目】下列说法正确的是
A. 因为p轨道是“8”字形的,所以p电子走“8”字形
B. 第三电子层,有3s、3p、3d三个轨道
C. 氢原子中只有1个电子,故氢原子只有一个轨道
D. 原子轨道与电子云都是用来形象描述电子运动状态的
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如下图所示。下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ。
C. Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种有机化合物的结构简式如下所示,均含有多个官能团,下列有关说法中正确的是( )

A. ①属于酚类,可与NaHCO3溶液反应产生CO2
B. ②属于酚类,能使FeCl3溶液显紫色
C. 1 mol ③最多能与3 mol Br2发生反应
D. ④属于醇类,可以发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水蕴藏着丰富的资源。下列有关海水综合利用的说法中,不正确的是
A.从海水中可提取食盐B.海水蒸馏可得淡水
C.直接电解海水可得镁D.从海水中可提取溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为延长舰船服役寿命可采用的电化学防腐的方法有①舰体与直流电源相连②舰体上镶嵌某种金属块。下列有关说法正确的是()
A. 方法①中舰体应连电源的正极 B. 方法②中镶嵌金属块可以是锌
C. 方法①为牺牲阳极的阴极保护法 D. 方法②为外加电流的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_________________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能__________________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到____________,恰好能使Fe3+、Al3+沉淀完全。
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-34 | 10-16 | 10-38 |
(3)滤渣B的成分是_____________________.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为____________________.
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为________________________________________________.
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1 Na2S2O3溶液反应(I2+2S2O32-====2I—+S4O62—)。计算可得该样品纯度为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. SiO2、NO、SO2、SO3属于非金属氧化物,又属于酸性氧化物
B. NH3形成铵盐的过程属于氮的固定
C. 纯铁的熔点比生铁低
D. 可以用光洁无锈的铁丝代替铂丝作焰色反应实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾在工业上具有广泛的应用,某研究性学习小组利用如图所示的实验装置制备氯酸钾。回答下列问题:
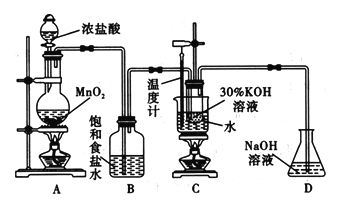
(1)写出装置C中发生反应的离子方程式:_______________________。
(2)若无B装置,则装置C中氯酸钾的产率将___________ (填“提高” “降低”或“无影响”)。
(3)在不同条件下KC1O3可将KI氧化为I2或KIO3。该小组设计了系列实验研究体系中硫酸浓度对反应产物的影响,实验的记录表如下表(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0. 20mol L-1KI/mL | V1 | 1.0 | 1.0 | 1.0 |
KC1O3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol L-1H2SO4/mL | 0 | 3.0 | V2 | 9.0 |
蒸馏水 | 9.0 | V3 | 3.0 | 0 |
实验现象 |
①实验设计表中V1=____________; V2 =_____________; V3 =_______________。
②设计1号试管实验的作用是_________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__________________。
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂C1O2,该反应的化学方程式为______________________ ;利用该反应原理,若工业上使用122.5吨KClO3与足量的Na2SO3反应,生成的ClO2用于除去工业废水中的Mn2+,可得到MnO2固体165吨,则该反应的产率约为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com