
| 甲 | 乙 | |
| A | H2、O2 | N2、CuO |
| B | HCl、NaOH | Fe、Al |
| C | SiO2、浓H2SO4 | NaOH、C |
| D | CO2、H2O | Na2O2、NaCl |
| A. | A | B. | B | C. | C | D. | D |
分析 A.O2和CuO不能发生反应;
B.NaOH和Fe不反应;
C.二氧化硅和氢氧化钠溶液反应,和碳反应生成硅单质,浓H2SO4和氢氧化钠溶液发生中和反应,浓H2SO4和C发生氧化还原反应;
D.CO2、H2O与NaCl都不反应.
解答 解:A.O2和CuO不能发生反应,故A不符合;
B.Fe无两性,不能与NaOH反应,故B不符合;
C.二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,和碳在高温下反应生成硅单质和CO,浓H2SO4和氢氧化钠溶液发生中和反应生成硫酸钠和水,和C在加热下发生氧化还原反应生成二氧化硫、二氧化碳和水,故C符合;
D.CO2、H2O与NaCl都不反应,故D不符合.
故选C.
点评 本题考查考查物质之间的反应,把握常见物质的性质及发生的化学反应为解答的关键,注意某些反应与量有关,明确性质与反应的关系即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
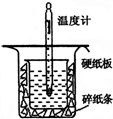 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- | |
| B. | 由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 molCl2,各转移2mole- | |
| C. | 由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1molS,各转移6mole- | |
| D. | 以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用胶头滴管取少量液体试剂 | B. | 用纸槽向试管底部加入粉未状药品 | ||
| C. | 用燃着的酒精灯点燃另一盞酒精灯 | D. | 用排水法收集难溶于水的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com