
| A. | 氯化铁溶液中加少量硫氰化钾溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| B. | 硫酸铜溶液中加过量氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ | |
| C. | 碘化钾溶液中加过量氯水:2I-+Cl2═I2+2Cl- | |
| D. | 苯酚钠溶液中通少量CO2: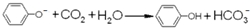 |
分析 A.反应生成络离子,不是沉淀;
B.反应生成[Cu(NH3)4]2+;
C.反应生成碘酸钾;
D.反应生成苯酚和碳酸氢钠.
解答 解:A.氯化铁溶液中加少量硫氰化钾溶液的离子反应为Fe3++3SCN-═Fe(SCN)3,故A错误;
B.硫酸铜溶液中加过量氨水的离子反应为Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O,故B错误;
C.碘化钾溶液中加过量氯水的离子反应为3H2O+I-+3Cl2═IO3-+6Cl-+6H+,故C错误;
D.苯酚钠溶液中通少量CO2的离子反应为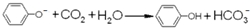 ,故D正确;
,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,选项BC为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
| C | KNO3和KOH混合溶液中加入铝粉 并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
| D | 向两份蛋白质溶液中分别滴加 Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
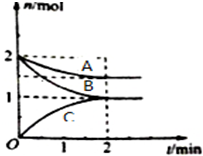 一定温度下,某容积为2L的密闭容器内,某一反应中A、B、C三种气体的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中A、B、C三种气体的物质的量随反应时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
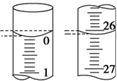 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol葡萄糖在酒化酶作用下水解生成2mol乙醇和2mol二氧化碳 | |
| B. | 在一定条件下CO和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 石油的重整可以提高汽油的质量和芳烃的产量 | |
| D. | 往蛋白质溶液中加入饱和硫酸钠溶液,产生的沉淀再加水又可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
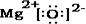 ,其化学键的类型为离子键.
,其化学键的类型为离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3分子是由极性键构成的极性分子 | |
| B. | NCl3分子的空间构型为三角锥形 | |
| C. | NCl3中的所有原子均达到8电子稳定结构 | |
| D. | NF3的沸点比NCl3的沸点低是因为N-F比N-Cl键键能小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
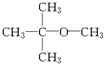 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com