
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
分析 (1)已知平衡常数K350℃<K300℃,说明升高温度平衡逆向移动,则该反应是放热反应;根据方程式可知逆反应方向的△S>0,△G=△H-T•△S<0反应自发进行;
(2)A.扩大容器体积,压强减小,平衡向逆反应方向移动,但NO2的浓度仍然比原来小;
B.恒温恒容下,再充入2molNO2和1molO2,则相当于增大压强,平衡向正反应方向进行;
C.在反应过程中质量和容积始终是不变的,因此密度始终是不变的;
D.平衡常数只与温度有关系,正反应是放热反应,因此如果该反应的平衡常数增大,则一定是降低了温度;
(3)①A.常温下,亚硝酸钠溶液的pH>7,这说明酸根水解,溶液显碱性,所以亚硝酸是弱酸;
B.亚硝酸能和NaOH发生中和反应是酸的通性;
C.用亚硝酸溶液做导电性实验,灯泡很暗,由于没有对比试验,因此不能判断亚硝酸是弱酸;
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4,这说明在稀释过程中亚硝酸又电离出氢离子,即存在电离平衡;
②a.H2O能电离出氢离子,属于酸,同时也能结合氢离子变为H3O+;
b.NO2-只能结合氢离子;
c.H2NCH2COOH能电离出氢离子,也能结合氢离子;
d.H2PO4-能电离出氢离子,也能结合氢离子;
e.H2S只能电离出氢离子,属于酸;
③Na2HPO4溶液与足量的CaCl2溶液反应生成磷酸钙沉淀和氯化氢,因此溶液显酸性;
(4)根据表中数据可知X是NaOH,Y是HNO3,W是NH4NO3,Z是NaNO2.将X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,其中硝酸和氢氧化钠恰好反应生成硝酸钠和水,即混合溶液是硝酸钠和亚硝酸钠形成的混合溶液,且二者的浓度相等,亚硝酸根水解,溶液显碱性;
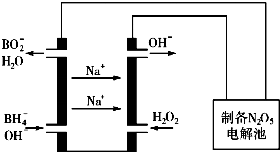
(5)原电池中负极失去电子,发生氧化反应,则硼氢化钠在负极放电,根据装置图可判断氢氧根参与负极反应生成BO2-与H2O.
解答 解:(1)已知平衡常数K350℃<K300℃,这说明升高温度平衡向逆反应方向进行,因此则该反应是放热反应;根据方程式可知逆反应方向的△S>0,因此根据△G=△H-T•△S可知常温下,该反应能逆向自发进行,
故答案为:放热;逆反应方向的△S>0;
(2)A.扩大容器体积,压强减小,平衡向逆反应方向移动,但NO2的浓度仍然比原来小,因此混合气体颜色变浅,故A错误;
B.恒温恒容下,再充入2molNO2和1molO2,则相当于增大压强,平衡向正反应方向进行,因此再次达到平衡时NO2转化率增大,故B正确;
C.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终是不变的,则不能根据密度判断反应是否得到平衡状态,故C错误;
D.平衡常数只与温度有关系,正反应是放热反应,因此如果该反应的平衡常数增大,则一定是降低了温度,故D正确,
故选:BD;
(3)①A.常温下,亚硝酸钠溶液的pH>7,这说明酸根水解,溶液显碱性,所以亚硝酸是弱酸,故A正确;
B.亚硝酸能和NaOH发生中和反应是酸的通性,不能说明亚硝酸是弱酸,故B错误;
C.用亚硝酸溶液做导电性实验,灯泡很暗,由于没有对比试验,因此不能判断亚硝酸是弱酸,故C错误;
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4,这说明在稀释过程中亚硝酸又电离出氢离子,即存在电离平衡,所以是弱酸,故D正确,
故选:AD;
②a.H2O能电离出氢离子,属于酸,同时也能结合氢离子变为H3O+,所以水是两性物质,故a正确;
b.NO2-只能结合氢离子,属于碱,故b错误;
c.H2NCH2COOH能电离出氢离子,也能结合氢离子,属于两性物质,故c正确;
d.H2PO4-能电离出氢离子,也能结合氢离子,属于两性物质,故d正确;
e.H2S只能电离出氢离子,属于酸,故e错误,
故选:acd;
③Na2HPO4溶液与足量的CaCl2溶液反应生成磷酸钙沉淀和氯化氢,因此溶液显酸性,反应的离子方程式为:3Ca2++2HPO42-=Ca3(PO4)2↓+2H+,
故答案为:3Ca2++2HPO42-=Ca3(PO4)2↓+2H+;
(4)根据表中数据可知X是NaOH,Y是HNO3,W是NH4NO3,Z是NaNO2.将X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,其中硝酸和氢氧化钠恰好反应生成硝酸钠和水,即混合溶液是硝酸钠和亚硝酸钠形成的混合溶液,且二者的浓度相等,亚硝酸根水解,溶液显碱性,所以混合溶液中各离子的浓度由大到小的顺序为:c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
(5)原电池中负极失去电子,发生氧化反应,则硼氢化钠在负极放电,根据装置图可判断氢氧根参与负极反应,因此硼氢化钠燃料电池的负极反应式为:BH4-+8OH--8e-=BO2-+6H2O,
故答案为:BH4-+8OH--8e-=BO2-+6H2O.
点评 本题考查化学平衡常数、化学平衡影响因素、反应自发性、弱电解质、盐类水解、原电池等,需要学生具备扎实的基础与灵活运用能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 金属单质置换金属单质 | B. | 金属单质置换非金属单质 | ||
| C. | 非金属单质置换金属单质 | D. | 非金属单质置换非金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉是混合物,漂粉精是纯净物 | |
| B. | 工业上将氯气通入澄清石灰水制取漂白粉 | |
| C. | 漂白粉的有效成分是Ca(ClO)2 | |
| D. | 漂白液的有效成份是Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:
已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃棒 | B. | 胶头滴管 | C. | 托盘天平 | D. | 容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com