
分析 根据四大基本反应类型的特点以及氧化还原反应与四大基本类型的关系分析判断,四大基本反应类型的特点如下,
化合反应的特点通俗一点就是“多变一”即反应后多种化合物转变成一种化合物;
分解反应的特点是由一种物质分解成多种物质“一变多”;
置换反应特点.一换一(即一种单质置换出另一种单质:A+BC=B+AC其中A,B为单质,BC为化合物);
复分解反应的特点:反应前后不会有化合价的变化,条件:一方面是对反应物的要求:酸盐、酸碱一般行,盐盐、盐碱都需溶;另一方面是对生成物的要求:生成物中有沉淀析出或有气体放出,或有水生成.
解答 解:A.Cu2S+O2═2Cu+SO2,属于置换反应,所有置换反应均属于氧化还原反应;
B.3O2═2O3,不属于四大基本反应类型,元素化合价没有发生改变,不属于氧化还原反应;
C.Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2,不属于四大基本反应类型,显然Fe的化合价发生了变化,属于氧化还原反应;
D.2Na+2H2O═2NaOH+H2↑,属于置换反应,所有置换反应均属于氧化还原反应;
E.CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑,一变多,属于分解反应,由于没有单质生成,不属于氧化还原反应;
F.2H2O2═3H2O+O2↑,一变多,属于分解反应,有单质生成,属于氧化还原反应;
G.SO3+H2O═H2SO4,多变一,属于化合反应,反应物中没有单质参加,不属于氧化还原反应;
H.2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,多变一,属于化合反应,反应物中有单质参加,属于氧化还原反应;
I.H2SO4+2NaOH═Na2SO4+2H2O,属于强酸和强碱发生的复分解反应,复分解反应只是交换离子,化合价均不改变,均不属于氧化还原反应;
故答案为:ACDFH;GH;EF;AD;I.
点评 本题考查了四大基本反应类型和氧化还原反应,难度不大,明确四大基本反应类型和氧化还原反应的特点与关系是解题的关键.


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 淀粉胶体加入电解质可发生聚沉现象 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体与溶液 | |
| D. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 溴的CCl4溶液 | D. | 银氨溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
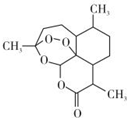 北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )
北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素能与NaOH溶液反应 | |
| C. | 青蒿素易溶于水、乙醇、苯等溶剂 | |
| D. | 用乙醚从青蒿中提取青蒿素,用到了萃取的原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:填空题
(本题满分18分)二甲 醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C=O | H﹣O | C﹣H |
E/(kJ.mol﹣1) | 436 | 343 | 1076 | 465 | 413 |
由上述数据计算△H1= ;
(2)该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
(3)下列措施中,能提高CH3OCH3产率的有 ;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是 ;
(5)以n(H2)/n(CO)=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
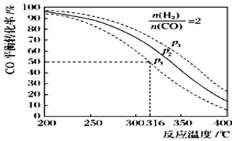
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时n(H2)/n(CO)=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
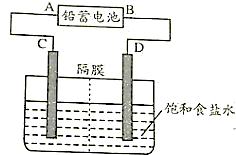
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨,已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是

A.电路中通过1mol电子时,Y电极质量增加48g
B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-===PbSO4(s)+2H2O(l)
C.c、d电极产生气体的物质的量之比为1∶2
D.X极为负 极
极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com