
| A. | NO2被还原 | B. | CO是氧化剂 | C. | CO发生还原反应 | D. | NO2失去电子 |
科目:高中化学 来源: 题型:解答题
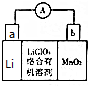 锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用,因此锂元素被誉为“能源元素”.请回答下列问题:
锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用,因此锂元素被誉为“能源元素”.请回答下列问题: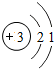 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
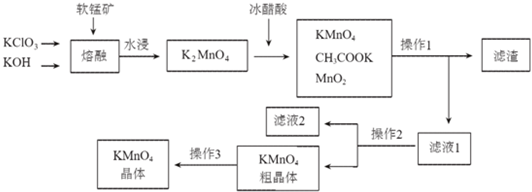
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数 | B. | 电子数 | C. | 中子数 | D. | 质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+的结构示意图: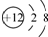 | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
| C. | H2O2的电子式: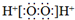 | |
| D. | 硫酸的电离方程式:H2SO4═H22++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将集有气体样品的试管倒扣于水槽中,试管中液面上升,则原气体样品中一定含NH3 | |
| B. | 将带火星的木条伸入盛满气体样品的集气瓶中,木条未复燃,则原气体样品中一定不含O2 | |
| C. | 将一定体积气体样品缓缓通入澄清石灰水中,未见有白色沉淀,则原气体样品中一定不含CO2 | |
| D. | 将一定体积气体样品缓缓通入水中,恰好完全反应生成一种盐,向所得盐溶液中加入澄清石灰水,未见沉淀生成,则原气体样品中V(NH3):V(O2)=4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
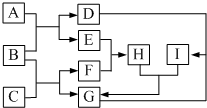 有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1.
有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
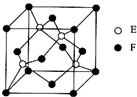 A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:
A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| D | 原子L电子层上有2对成对电子 |
| E | E与D同主族 |
| F | 基态F+核外有3层电子且各层均处于全满状态 |
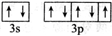 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
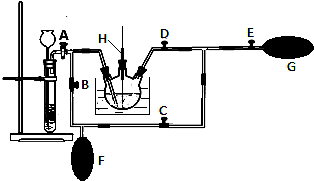
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com