
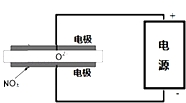
 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).分析 (1)元素化合价升高发生氧化反应得到氧化产物;根据P元素化合价变化计算转移电子物质的量;
(2)①由电离平衡常数可知,酸性:H2CO3>HCN>HCO3-,则NaCN溶液通入少量CO2生成NaHCO3与HCN;
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,配平书写方程式;
③电解池阴极发生还原反应,NOx在阴极获得电子生成N2、O2-;
(3)①已知:Ⅰ.2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.47kJ•mol-1
Ⅱ.NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+72.49kJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ可得:2NH3(g)+CO2(g)═CO(NH2)(s)+H2O(g);
②铁粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铁粉,生成Fe(NO3)2和NO气体0.02mol,根据电子转移守恒计算参加反应的Fe的物质的量,再根据Fe原子守恒计算溶液中n[Fe(NO3)2],再向溶液中足量稀硫酸至不再反应为止,容器剩余Fe粉m2g,Fe(NO3)2中NO3-发生反应3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,(m1-m2)为与溶液中NO3-反应的Fe的质量.
解答 解:(1)反应中P元素化合价升高得到H3PO4,氧化产物为H3PO4,若有1mol P4参加反应转移电子为1mol×4×5=20mol,
故答案为:H3PO4;20;
(2)①由电离平衡常数可知,酸性:H2CO3>HCN>HCO3-,则NaCN溶液通入少量CO2生成NaHCO3与HCN,反应方程式为:CO2+NaCN+H2O=NaHCO3+HCN,
故答案为:CO2+NaCN+H2O=NaHCO3+HCN;
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,反应方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑,
故答案为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
③电解池阴极发生还原反应,NOx在阴极获得电子生成N2、O2-,阴极电极反应式为:2NOx+4xe-=N2+2xO2-,
故答案为:2NOx+4xe-=N2+2xO2-;
(3)①已知:Ⅰ.2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.47kJ•mol-1
Ⅱ.NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+72.49kJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ可得:2NH3(g)+CO2(g)═CO(NH2)(s)+H2O(g),△H=-159.47kJ•mol-1+72.49kJ•mol-1=-86.98kJ•mol-1,
故答案为:-86.98;
②铁粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铁粉,生成Fe(NO3)2和NO气体,NO的物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,根据电子转移守恒可知,参加反应的Fe的物质的量为$\frac{0.02mol(5-2)}{2}$=0.03mol,根据Fe原子守恒可知,溶液中n=0.03mol,溶液中n(NO3-)=0.06mol.
再向溶液中足量稀硫酸至不再反应为止,Fe(NO3)2中NO3-发生反应3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,容器剩有铜粉m2g,(m1-m2)为与溶液中NO3-反应的铜的质量,
令再次反应的铜的物质的量为xmol,则:
3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
3 2
xmol 0.06mol
所以x=0.09mol
所以再次反应的Fe的质量为0.09mol×56g/mol=5.04g,即(m1-m2)=5.04g,
故答案为:5.04.
点评 本题考查氧化还原反应基本概念与计算、化学方程式书写、电解原理、反应热计算等,(3)中关键是判断(m1-m2)为与溶液中NO3-反应的Fe的质量,注意根据电子转移守恒、元素守恒计算,如根据方程式计算,相对比较麻烦,注意守恒思想在氧化还原反应计算中应用,尤其硝酸根完全反应,利用离子方程式计算.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ① | C. | ④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煮沸水消灭水当中的细菌 | |
| B. | 加强酸或强碱对餐具进行消毒 | |
| C. | 用甲醛气体对食物进行消毒 | |
| D. | 用重金属盐消毒后加牛奶冲洗后再食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 | |
| B. | 苯不能使酸性高锰酸钾褪色,说明苯环中没有碳碳双键 | |
| C. | 甲烷中混有的乙烯可以用溴的四氯化碳溶液除去 | |
| D. | 医院用75%酒精杀菌、消毒,75%是指质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉碘化钾溶液加酸后变蓝:4I-+O2+4H+═2I2+2H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 在Fe(NO3)2和KI组成的混合溶液中滴入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-5mol/L | B. | 1×10-12mol/L | C. | 1×10-6mol/L | D. | 1×10-7mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com