
【题目】已知20℃时,饱和NaCl溶液的密度为ρg/cm3 , 物质的量浓度为c mol/L,则下列说法中不正确的是( )
A.温度低于20℃时,饱和NaCl溶液的浓度小于c mol/L
B.此溶液中NaCl的质量分数为 ![]()
C.20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液
D.20℃时,饱和NaCl溶液的溶解度 ![]()
【答案】D
【解析】解:A.温度低于20℃时,氯化钠饱和溶液中溶解的氯化钠减少,所以饱和NaCl溶液的浓度小于c mol/L,故A正确; B.1L该温度下的氯化钠饱和溶液中,溶液质量为:1000ρg,氯化钠的物质的量为cmol,所以氯化钠的质量分数为: ![]() =
= ![]() ,故B正确;
,故B正确;
C.20℃时,等体积的饱和溶液中含有氯化钠的物质的量达到最大,所以密度小于ρg/cm3的NaCl溶液是不饱和溶液,故C正确;
D.20℃时,1L饱和NaCl溶液中溶解的氯化钠的质量为58.5cg,溶液质量为1000ρ,则该温度下氯化钠的溶解度为:S= ![]() ×100g=
×100g= ![]() g,故D错误;
g,故D错误;
故选D.
A.温度降低,氯化钠的溶解度减小,溶液中氯化钠的物质的量浓度减小;
B.根据1L溶液中含有的氯化钠的质量、溶液的质量计算出氯化钠的质量分数;
C.相同温度下,氯化钠饱和溶液的密度最大,若氯化钠溶液密度小于饱和溶液的密度,则该溶液一定为不饱和溶液;
D.设溶液体积为1L,根据氯化钠密度、浓度及溶解度表达式计算出该温度下的溶解度.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq)I3﹣(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( ) 
A.反应I2(aq)+I﹣(aq)I3﹣(aq)的△H>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3 , 还含有硅、铝等杂质.制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
(2)滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质.
(3)步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示).
(4)有关物质的溶解度如图所示.
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 .
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液,B和C反应发出苍白色火焰。请回答:
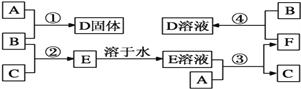
(1)A是_________,B是_________,C是_________![]() 填写化学式
填写化学式![]() ;
;
(2)反应①的化学方程式 ______________________________________;
(3)反应③的离子方程式 _____________________________________;
(4)反应④的离子方程式 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数(填“大于”、“小于”或“等于”)40%,如果等体积混合,混合后溶液的质量分数(填“大于”、“小于”或“等于”)40%.
(2)已知98%的浓H2SO4的物质的量浓度为18.4molL﹣1 , 试判断49%的H2SO4的物质的量浓度(填“大于”、“小于”或“等于”)9.2molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
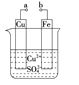
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b连接时,铜片上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶2 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置:

请按要求回答下列问题。
(1)元素③的名称是______,元素④在周期表中所处位置____________,元素④形成的单质具有____________ (填“氧化性”或“还原性”)。
(2)元素④⑦⑧的气态氢化物的稳定性由弱到强的顺序: _____________________ (用化学式表示)。
(3)写出一条能说明元素⑤的金属性比元素⑥强的事实:_____________ 。
(4)写出元素⑤形成的单质与水反应的离子方程___________。
(5)用电子式表示元素⑥与元素⑨形成的化合物的形成过程____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com