
分析 氯化铝溶液中加入少量氢氧化钠溶液生成白色沉淀氢氧化铝,Al(OH)3具有两性,继续加入氢氧化钠溶液沉淀会溶解消失,以此解答该题.
解答 解:在AlCl3溶液中滴加少量NaOH溶液,反应生成氢氧化铝白色沉淀,反应方程式为:3NaOH+AlCl3=Al(OH)3↓+3NaCl,继续加入氢氧化钠溶液,Al(OH)3具有两性,可与NaOH反应生成NaAlO2,反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,氢氧化铝沉淀消失,
故答案为:产生白色沉淀;3NaOH+AlCl3=Al(OH)3↓+3NaCl;沉淀溶解;Al(OH)3+NaOH=NaAlO2+2H2O.
点评 本题考查了铝的化合物的性质,掌握两性氢氧化物氢氧化铝的性质是解题关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
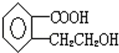 1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟1mol NaOH反应.1mol该有机物可以跟3mol氢气反应.
1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟1mol NaOH反应.1mol该有机物可以跟3mol氢气反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性比硫强 | B. | 气态氢化物的化学式为H2Se | ||
| C. | 酸性:H2SeO4>H2SO4 | D. | 最高价氧化物的化学式是SeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
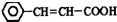 ,可由化合物甲生成.其转化关系及相应反应如下:
,可由化合物甲生成.其转化关系及相应反应如下: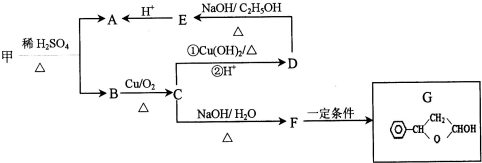

 .
. (写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为
(写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为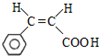 .
.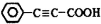 是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的
是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的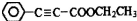 路线(其他试剂任选)
路线(其他试剂任选)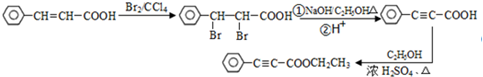 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
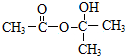 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碘单质能升华是由于碘单质分子间的键能较小 | |
| B. | 键能越大,则含该键的分子受热越易分解为原子 | |
| C. | 燃料燃烧过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | H-Cl键的键能为431kJ•mol-1,H-I键的键能为299kJ•mol-1,这说明HCl分子比HI分子稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431KJ | B. | 649KJ | C. | 869KJ | D. | 945.6KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com