
| X | Y | W | |
| 起始状态(mol) | 2 | 1 | 0 |
| 平衡状态(mol) | 1 | 0.5 | 1.5 |
| A. | 该温度下,该反应的平衡常数K=9 | |
| B. | 升高温度,若W的体积分数减小,此反应△H>0 | |
| C. | 该温度下,该反应的方程式为 2X(g)+Y(g)?3W(g) | |
| D. | 增大压强,正、逆反应速率都增大,平衡向正反应方向移动 |
分析 由表中数据可知,△n(X)=1mol、△n(Y)=0.5mol、△n(W)=1.5mol,物质的量变化量之比等于化学计量数之比,所以,△n(X):△n(Y):△n(W)=1mol:0.5mol:0.5mol=2:1:3,反应方程式为2X+Y?3W,计算平衡时各物质的浓度,结合K=$\frac{{c}^{3}(W)}{{c}^{2}(X)c(Y)}$计算常数,以此解答该题.
解答 解:由表中数据可知,△n(X)=1mol、△n(Y)=0.5mol、△n(W)=1.5mol,物质的量变化量之比等于化学计量数之比,所以,△n(X):△n(Y):△n(W)=1mol:0.5mol:0.5mol=2:1:3,反应方程式为2X+Y?3W,
A.反应方程式为2X+Y?3W,反应前后气体的物质的量相同,可以利用物质的量代替浓度计算平衡常数,所以平衡常数k=$\frac{{c}^{3}(W)}{{c}^{2}(X)c(Y)}$=$\frac{1.{5}^{3}}{{1}^{2}×0.5}$=6.75,故A错误;
B.升高温度,若W的体积分数减小,说明平衡逆向移动,则正反应放热,此反应△H<0,故B错误;
C.由以上分析可知该温度下,该反应的方程式为 2X(g)+Y(g)?3W(g),故C正确;
D.方程式为 2X(g)+Y(g)?3W(g),反应前后体积不变,增大压强,平衡不移动,故D错误.
故选C.
点评 本题考查平衡常数计算、外界条件对平衡移动的影响等,为高考常见题型和高频考点,难度中等,判断反应方程式是解题关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 生物质能来深于植物及其加工产品所贮存的能量,直接燃烧是利用方式之一 | |
| B. | 石油的裂化与裂解都是化学变化,而煤的气化与液化是物理变化 | |
| C. | 用高压氢气、氧气制作燃料电池是氢能源利用的一种重要方式 | |
| D. | 化学反应过程中反应物的总能量小于生成物的总能量,往往伴随热量的吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由小到大的顺序为r(X)<r(Y)<r(Z)<r(W) | |
| B. | X、Y、Z既能形成离子化合物,又能形成共价化合物 | |
| C. | Z分别能与X、Y和W形成多种化合物 | |
| D. | 与单质W比较,单质Z更容易与单质X化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.7 mol/L | B. | 8.5 mol/L | C. | 9.6 mol/L | D. | 10.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入适量水 | B. | 加入适量NaOH固体 | ||
| C. | 通入适量的O2 | D. | 加入适量的CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.2mol•L-1•s-1 | B. | z=3 | ||
| C. | B的转化率为25% | D. | C平衡时的浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: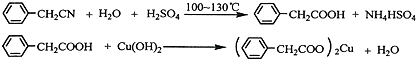
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com