

分析 A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大;元素A是原子半径最小的元素,则A是H元素;B元素基态原子的核外电子分占四个原子轨道(能级),则B为C元素;D元素原子的已成对电子总数是未成对电子总数的3倍,则D是O元素,C元素原子序数大于B而小于D,则C是N元素;E与D处于同一主族,则E是S元素;F位于ds区,且原子的最外层只有1个电子,则F为Cu元素;
(1)Cu+是Cu原子失去最外层电子得到的离子,其离子核外有28个电子,根据构造原理书写亚铜离子核外电子排布式;
(2)B、C、D分别是C、N、O元素,且位于同一周期,同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)C、N元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物为乙烷;
含有氢键的氢化物熔沸点较高;
(4)H、C、O可形成分子式为H2CO的某化合物,为HCHO,该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式;一个甲醛分子中含有1个π键;
(5)N、Cu两元素形成的某化合物的晶胞结构如图所示,利用均摊分计算该晶胞中N、Cu原子个数,从而确定其化学式;该晶胞中N原子配位数为6.
解答 解:A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大;元素A是原子半径最小的元素,则A是H元素;B元素基态原子的核外电子分占四个原子轨道(能级),则B为C元素;D元素原子的已成对电子总数是未成对电子总数的3倍,则D是O元素,C元素原子序数大于B而小于D,则C是N元素;E与D处于同一主族,则E是S元素;F位于ds区,且原子的最外层只有1个电子,则F为Cu元素;
(1)Cu+是Cu原子失去最外层电子得到的离子,其离子核外有28个电子,根据构造原理书写亚铜离子核外电子排布式为1s22s22p63s23p63d10{或[Ar]3d10},
故答案为:1s22s22p63s23p63d10{或[Ar]3d10};
(2)B、C、D分别是C、N、O元素,且位于同一周期,同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)C、N元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物为C2H6;
含有氢键的氢化物熔沸点较高,氮的氢化物中含有氢键而碳的氢化物中不含氢键,所以氮的氢化物熔沸点较高,
故答案为:C2H6;氮的氢化物(N2H4)分子间存在氢键;
(4)H、C、O可形成分子式为H2CO的某化合物,为HCHO,该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式为sp2;一个甲醛分子中含有1个π键,则1mol甲醛中含有1molπ键,
故答案为:sp2;1mol;
(5)N、Cu两元素形成的某化合物的晶胞结构如图所示,该晶胞中Cu原子个数=12×$\frac{1}{4}$=3、N原子个数=8×$\frac{1}{8}$=1,所以其化学式为Cu3N;该晶胞中N原子配位数为6,
故答案为:Cu3N;6.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、元素周期律等知识点,侧重考查学生知识运用及分析判断、计算能力,注意价层电子对个数的计算方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Fe3+在反应①中作氧化剂,在反应②中为氧化产物 | |
| B. | 若生成标准状况下22.4 L O2,则整个过程中转移电子总数为2 mol | |
| C. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| D. | 在工业生产H2O2过程中要严格避免混入Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 室温下,21.0g乙烯和丁烯的混合气体中含有的C-H共价键数目为3NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高a的反应温度,乙醇的转化率增大 | |
| B. | 由b可知:乙醇的燃烧热为13.8 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=+485.6 kJ•mol-1 | |
| D. | 制取等量的氢气,途径b消耗的能量更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 块状固体药品的取用:一横、二放、三慢竖 | |
| B. | 液体药品的倾倒:瓶塞倒放、紧挨瓶口、缓慢倒入 | |
| C. | 分液的操作:静置分层后将分液漏斗中下层液从下口放出,再将上层液从上口倒出 | |
| D. | 冷凝管的使用:冷却水下口进,上口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 置换反应 | C. | 氧化还原反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
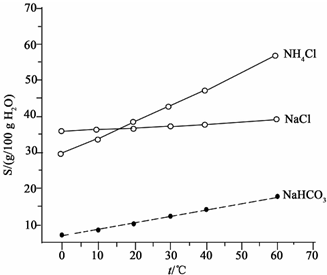
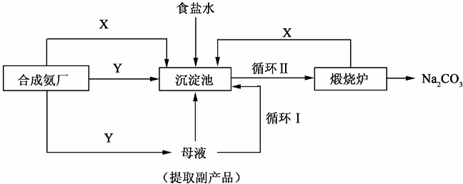
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com