
| A. | 1mol乙烷含C-H键的数目为7NA | |
| B. | 1L0.5mol/LNa2S溶液中HS-的数目为0.5NA | |
| C. | 标准状况下,Na与水反应产生22.4 LH2时转移电子数目为2 NA | |
| D. | 含1mol HCOOH的水溶液中含氧原子的总数目为2NA |
分析 A.1mol乙烷含6molC-H键;
B.HS-易水解;
C.反应生成1mol氢气需要2mol电子;
D.除了甲酸含有氧原子,水也含氧原子.
解答 解:A.1mol乙烷含6molC-H键,含C-H键的数目为6NA,故A错误;
B.硫离子部分水解,HS-数目小于0.5NA,故B错误;
C.反应生成1mol氢气需要2mol电子,Na与水反应产生22.4 LH2时转移电子数目为2 NA,故C正确;
D.除了甲酸含有氧原子,水也含氧原子,故溶液中所含的氧原子的物质的量大于2mol,即大于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 充电时MgxMo3S4只发生还原反应 | |
| B. | 放电时Mo3S4只发生氧化反应 | |
| C. | 充电时阳极反应式为 Mo3S42x--2xe-=Mo3S4 | |
| D. | 放电时负极反应式为xMg=xMg2+-2xe- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| D | ||
| A | B | C |
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
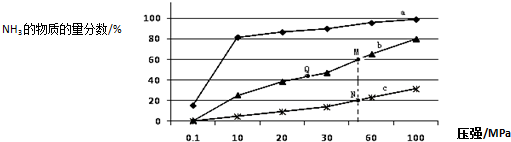
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
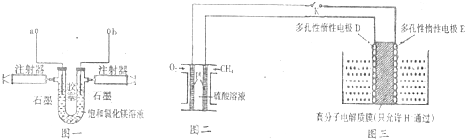
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料、橡胶、合成纤维、酚醛树脂都属于有机高分子化合物 | |
| B. | 鸡蛋清中加入Na2SO4、CuSO4都会因盐析产生沉淀 | |
| C. | 油脂的皂化反应生成高级脂肪酸和丙醇 | |
| D. | 通过石油催化重整是获得烯烃的主要途径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com