
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(CuO) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 滴有酚酞的NaOH试液 | 品红溶液 | 淀粉和碘水混合液 |
| 现象 | 溶液红色消失 溶液红色消失 |
品红褪色 品红褪色 |
蓝色褪色 蓝色褪色 |
| 体现SO2的性质 | 酸性 酸性 |
漂白性 漂白性 |
还原性 还原性 |
查看答案和解析>>
科目:高中化学 来源:2014届安徽省江南十校新高三摸底联考化学试卷(解析版) 题型:实验题
某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,设计了如下过程:
Ⅰ、有关资料
铜的化合物颜色性质如下:
|
物质 |
颜色、性质 |
物质 |
颜色、性质 |
|
氢氧化铜Cu(OH)2 |
蓝色固体不溶于水 |
硫酸铜(CuSO4) |
溶液呈蓝色 |
|
氧化亚铜(CuO) |
红色固体不溶于水 |
氯化铜(CuCl2) |
溶液呈绿色,稀溶液呈蓝色 |
|
氯化亚铜(CuCl) |
白色固体不溶于水 |
碱式氯化铜 |
绿色固体不溶于水 |
Ⅱ、探究实验
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;②白色物质为铜的化合物,其化学式可能为CuCl
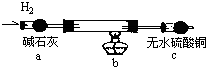
(2)实验验证:取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色。
①碳棒上的红色物质是否有Cu2O (填“是”或“否”),理由是
;②在c装置后将气体通入 中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在;③写出装置b中发生反应的化学方程式:
。
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和 ;②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入 后继续电解,出现白色物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,设计了如下过程:
Ⅰ、有关资料
铜的化合物颜色性质如下:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(CuO) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
Ⅱ、探究实验
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;②白色物质为铜的化合物,其化学式可能为CuCl
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物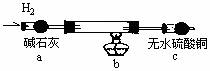
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色。
①碳棒上的红色物质是否有Cu2O (填“是”或“否”),理由是
;②在c装置后将气体通入 中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在;③写出装置b中发生反应的化学方程式:
。
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e—=Cu和 ;②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入 后继续电解,出现白色物质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com