
| A、9 | B、12 | C、16 | D、20 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、 装置①为放出萃取溴水后的苯层 |
B、 装置②为喷泉实验 |
C、 装置③不能用来吸收HCl气体 |
D、 以NH4Cl为原料,装置④可用于制备少量NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时正极反应为:Zn-2e-+2OH-═Zn(OH)2 |
| B、该原电池,Zn作正极,可用石墨等作负极 |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D、放电时正极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度 |
| B、四种溶液中,水的电离程度最大的是NaClO |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液 |
| D、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X中一定含有两种官能团:羟基和碳碳双键 |
| B、Y的分子式为C4H6O2,其可能结构有3种 |
| C、Y的分子式为C4H8O2,其属于酯类的结构有4种 |
| D、X和Y都能和碳酸氢钠反应,产生二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| B、使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 |
| C、检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| D、用10mL量筒量取9.2mL NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
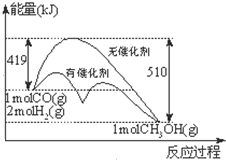 反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )| A、达到平衡时,升高温度,CO的转化率减小 |
| B、1mol CO(g)和2mol H2(g)在密闭容器中反应,达平衡时,放出的热量为91KJ |
| C、相同条件下,1mol CO(g)和2mol H2(g)完全反应生成1mol液态CH3OH放出的热量大于91KJ |
| D、反应热取决于反应物总能量与生成物总能量的相对大小,与反应发生的条件无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com