
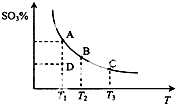
 二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法错误的是( )
二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法错误的是( )| A. | 在D点时v正>v逆 | |
| B. | 其他条件不变,增大氧气的浓度可以提高二氧化硫的转化率 | |
| C. | 若B、C点的平衡常数分别为KB、KC,则KB>KC | |
| D. | 恒温恒容下向平衡体系中通入氦气,平衡向右移动 |
分析 A、曲线上的点都是平衡点,D点SO3的百分含量低于相同温度平衡点的含量,说明D点未到达平衡状态,反应向正反应移动;
B、增大氧气的浓度,平衡正向移动;
C、升高温度,平衡向逆反应移动,故温度越高平衡常数越小;
D、恒温恒压下向平衡体系中通入氦气,体积增大,压强降低,平衡向体积增大的方向移动.
解答 解:A、曲线上的点都是平衡点,D点SO3的百分含量低于相同温度平衡点的含量,说明D点未到达平衡状态,反应向正反应移动,故v正>v逆,故A正确;
B、增大氧气的浓度,平衡正向移动,所以可以提高二氧化硫的转化率,故B正确;
C、升高温度,平衡向逆反应移动,故温度越高平衡常数越小,B点的温度低于C的温度,故平衡常数,KB>KC,故C正确;
D、恒温恒压下向平衡体系中通入氦气,体积增大,参与反应气体压强降低,平衡向体积增大的方向移动,即向平衡向左移动,故D错误.
故选D.
点评 本题考查化学平衡图象、化学平衡移动的影响因素等,难度中等,注意根据SO3的含量判断平衡移动的方向.


科目:高中化学 来源: 题型:解答题
 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面开始没有气体产生,后来与Y电极产生的无色气体体积相同(标况);停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g;不考虑电解前后溶液体积变化.下列有关说法中不正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面开始没有气体产生,后来与Y电极产生的无色气体体积相同(标况);停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g;不考虑电解前后溶液体积变化.下列有关说法中不正确的是( )| A. | Y电极是阳极 | |
| B. | X电极产生气体标准状况下的体积为0.56L | |
| C. | 要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3 | |
| D. | 电解后溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)?3C(g).如图是A的反应速率v(A)随时间变化的示意图.下列说法正确的是( )
在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)?3C(g).如图是A的反应速率v(A)随时间变化的示意图.下列说法正确的是( )| A. | 反应物A的浓度:a点小于b点 | |
| B. | 该反应的某种生成物可能对反应起催化作用 | |
| C. | 曲线上的c、d两点都表示达到平衡状态 | |
| D. | A的平均反应速率:ab段大于bc段 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )| A. | 根据隔板K滑动与否可判断左右两边的反应是否达到平衡 | |
| B. | 达到平衡后,隔板K最终停留在左侧刻度0--2之间 | |
| C. | 到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量 | |
| D. | 若平衡时K停留在左侧1处,则活塞停留在右侧5--6之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com