
【题目】碘循环工艺能吸收SO2降低环境污染,同时又能制得氢气。用稀土吸收H2后的储氢材料作为电极材料,以KOH溶液作电解质溶液(电池内部气体可从一个电极扩散到另一个电极)形成的可逆电池的总反应为NiO(OH)十MH ![]() Ni(OH)2+M。下列说法不正确的是
Ni(OH)2+M。下列说法不正确的是
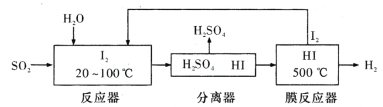
A. 反应器中发生反应的离子方程式是SO2+I2+2H2O![]() 4H++SO42-+2I-
4H++SO42-+2I-
B. 分离器中的副产品是硫酸
C. 过程中循环利用的物质是I2
D. 该电池充电完后若持续充电,在一个电极上会产生O2而使电池发生爆炸
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法错误的个数是
①标准状况下,2.24L CH2Cl2含有的分子数为0.1 NA
②1mol苯甲酸中含有双键的数目为NA
③同温同压下,2 NA个C2H4(g)与NA个C4H8(g)的密度相等
④15g甲醛(HCHO)和乙酸的混合物中氧原子数为0.5NA
A. 2个 B. 3个 C. 4个 D. 1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如下图所示,下列说法正确的是
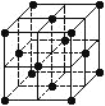
A. C60属于离子晶体
B. C60摩尔质量是720
C. 在C60晶胞中平均每个晶胞有14个C60分子
D. 每个C60分子周围与它距离最近等距离的C60分子有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y),共17种元素。稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)镧系元素位于元素周期表第_______族,镧系元素位于周期表的______区。
(2)钪(Sc)为21号元素,其基态原子M能层电子数为_______;基态镝(Dy)原子的电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为______。
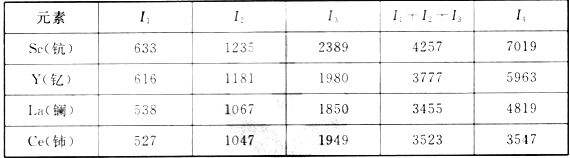
(3)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据,判断表中最可能有+4价的元素是___。
几种稀土元素的电离能(单位:kJ·mol-1):
(4)Sm(钐)的单质与1,2-二碘乙烷可发生反应Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子的杂化轨道类型为_____,1 mol CH2=CH2中含有的σ键数目为____。常温下,1,2-二碘乙烷为液体而乙烷为气体,其主要原因是_____。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有_____个氧原子。
(6)Ce(铈)单质为面心立方晶体,其相对原子质量为140,其晶胞参数为α=516pm。晶胞中Ce(铈)原子的配位数为______。列式表示Ce(铈)单质的密度为______g·cm-3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。
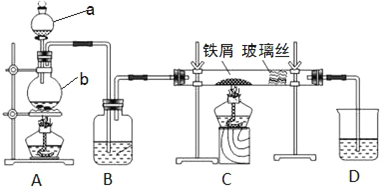
(1)写出仪器的名称:a_______,b________。
(2)A中反应的化学方程式为________。C中反应的化学方程式为________。
(3)装置B中加入的试剂是________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置__和__(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:________。
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X。证明溶液X中含有FeCl3的试剂是________,观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向xmL 0. 1 mol/L氨水中滴加等物质的量浓度的稀H2SO4 ,测得混合溶液的温度和pOH[pOH==-lg c(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化)。下列说法不正确的是
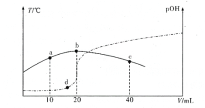
A. x=40
B. a, b,c三点由水电离出的c(H+)依次减小
C. b点时溶液的pOH>pH
D. a,b.d三点对应的NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为______________(填“吸热”或“放热”)反应。
(2)能判断该反应是否达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。该温度下,若向该容器中充入n(CO2)=1 mol,n(H2)=1 mol,4 min末达到平衡,CO2的转化率为_____________,H2的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
实验序号 | ① | ② |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 |
褪色时间/s | 116 | 6 |
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____。
实验序号 | ③ |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
褪色时间/s |
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10/span>-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________mg·kg-1(计算结果保留整数即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com