
下列关于电解质溶液的叙述正确的是
A. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
B. pH相同的盐酸和醋酸溶液,加水稀释100倍后两溶液pH仍相同
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.25 ℃,将pH = 5的盐酸稀释1000倍后,溶液的pH=8
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(1)多少克锌与500ml 0.1mol/L硫酸恰好反应,在标准状况下能生成多少升氢气?
(2)计算溶质的质量分数为36.5%的浓盐酸(密度为1.19g/cm3)的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
容积固定的密闭容器中存在如下反应:A(g)+3B(g)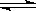 2C(g) △H<0
2C(g) △H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
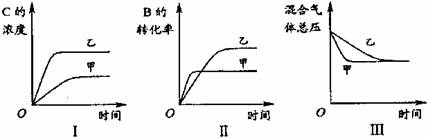
下列判断一定错误的是
①图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
②图Ⅱ研究的是压强对反应的影响,且甲的压强较高
③图Ⅱ研究的是温度对反应的影响,且甲的温度较高
④图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
⑴该温度下,水的离子积常数Kw= 。
⑵在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= 。
⑶该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
⑷该温度下,pH=3的硫酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7);pH=3的醋酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.活化分子间所发生的碰撞为有效碰撞
B.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数
D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C. 若容器内气体压强不随时间变化,则可以判断该反应已达到化学平衡状态
D. 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | a kJ |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为23.15 kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是 ( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl‾、S2‾、Ca2+、K+半径逐渐减小
D.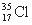 与
与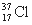 得电子能力相同
得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
有a、b、c、d四种金属。将a与b连接起来,浸入电解质溶液中,a溶解。将a、d分别投入等浓度的盐酸中,d比a反应强烈。将铜浸入b的盐溶液里,无明显变化。如果把铜浸入c的盐溶液里,有金属c析出。据此判断它们的活动性顺序由强到弱的为( )
A.a > c > d > b B.d > a > b > c
C.d > b > a > c D.b > a > d > c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com