
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 376.6mL |
| ② | 1.0g | 10.0mL | 364.7mL |
| ③ | 1.0g | 10.0mL | 377.0mL |
分析 (1)实验Ⅰ装置中有空气,一氧化氮与空气反应生成二氧化氮,二氧化氮溶于水;
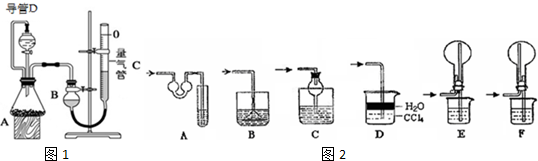
(2)氨气极易溶于水,量气管中的液体应该不含水且不与氨气反应,最好用煤油;极易溶于水的气体,若吸收时导管伸入水中,由于气体溶于水,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象;
(3)①铝与氢氧化钠反应生成偏铝酸钠和氢气;
②在对量气管进行每一次读数时,都应注意保持装置B与装置C液面相平,并使视线与凹液面最低处相平;实验前,如拆去导管D,流下的液体会占据来之不易的体积,使得测得的气体体积将偏大;
③实验Ⅲ,铝和氢氧化钠反应,根据量气管的第二次读数-第一次读数=生成氢气的体积,求出生成氢气的平均值,再求出合金中铝的质量,最后计算出镁铝合金中铝的质量分数.
解答 解:(1)一氧化氮与氧气反应生成二氧化氮,二氧化氮可与水反应生成一氧化氮和硝酸;装置Ⅰ中有空气,一氧化氮会与装置中的空气反应,生成的二氧化氮溶于水并与水反应,使测得的一氧化氮体积不准,所以不可以通过实验I收集并测量NO气体的体积来探究铜样品的纯度,
故答案为:NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准;
(2)氨气为碱性气体,极易溶于水,量气管中的液体应该不含水且不与氨气反应,浓NaOH溶液、氨水、氯化铵溶液中含有水,氨气被水吸收,而氨气不溶于煤油,所以量气管中液体最好是煤油,故选C;
A、对于极易溶于水的气体,吸收装置中的导管外联双球状导管内伸入到液体中,液体进入双球内,防止进入前端装置,能防止倒吸,故A正确;
B、吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸,故B错误;
C、对于极易溶于水的气体,吸收装置中的导管与干燥管连接,当水进入干燥管内,烧杯内液面下降低于导管口,液体又流落到烧杯中,能防止倒吸,故C正确;
D、氨气极易溶于水,不溶于四氯化碳,所以导管通入四氯化碳中,气泡向上到水层溶解,能防止倒吸,故D正确;
E、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶口,液体经进气管倒流入前端装置,产生倒吸,故E错误;
F、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶底部,液体不能流入前端装置,能防止倒吸,故F正确;
所以能防倒吸的吸收装置有acdf,不能防倒吸的为BE,
故答案为:C; BE;
(3)①铝与氢氧化钠反应生成偏铝酸钠和氢气,离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
②在对量气管进行每一次读数时,都应注意保持装置B与装置C液面相平,并使视线与凹液面最低处相平;实验前,如拆去导管D,流下的液体会占据来之不易的体积,使得测得的气体体积将偏大,
故答案为:保持装置B与装置C液面相平;偏大;
③第2次测量数据误差较大,应该舍弃,铝和氢氧化钠反应生成氢气的体积为:$\frac{(376.6-10.0)+(377.0-10)}{2}$=366.8mL=0.3668L,
设生成0.3668L氢气,需铝的质量为x
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54g 3×24.5L
x 0.3668L
则:x=$\frac{54g×0.3668L}{3×24.5L}$=0.269g,
铝的质量分数为:$\frac{0.269g}{1.0g}$×100%=26.9%,
故答案为:26.9%.
点评 本题考查了物质性质实验方案的设计方法,题目难度中等,明确常见物质的性质及实验操作基本方法为解答关键,试题侧重考查学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥⑦ | B. | ②③⑤⑦ | C. | ①③⑦ | D. | ①②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在KMnO4溶液中:SO42-、Mg2+、CH3CH2OH、NO3- | |
| B. | 在由水电离的氢离子浓度为1×10-12mol/L的溶液中:Fe2+、Na+、NO3-、Cl- | |
| C. | 离子浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ | |
| D. | 无色溶液中:Fe3+、NO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=5的NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| B. | 在0.1mol•L-1 CH3COONa溶液中:n(OH-)+0.1mol>n(CH3COOH)+n(H+)+n(Na+) | |
| C. | 向AgBr的饱和溶液中加入NaCl固体,有白色固体析出,说明AgCl比AgBr更难溶 | |
| D. | 10mL 0.01mol•L-1 H2SO4溶液与10mL 0.01mol•L-1 NaOH溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
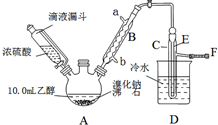 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③④⑤⑧ | C. | ①②③⑥⑧ | D. | ②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汞 | B. | 氧化汞 | C. | 氧化铝 | D. | 硝酸铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com