
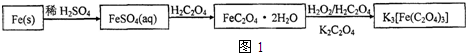
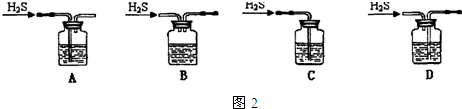
分析 (1)洗气装置中导气管应该采用“长进短出”原则;
(2)Fe2+易水解导致溶液浑浊,酸能抑制Fe2+水解;
若要从溶液中得到绿矾FeSO4•7H2O,应该采用蒸发浓缩、冷却结晶、过滤洗涤、干燥操作;
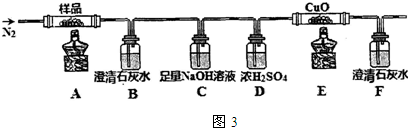
(3)三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应,根据元素守恒推测得到的产物可能是K2CO3、FeO、Fe、CO2、CO,A加热三草酸合铁(Ⅲ)酸钾晶体分解,B装置澄清石灰水检验二氧化碳存在,C足量氢氧化钠吸收二氧化碳,D浓硫酸干燥气体,E中有黑色氧化铜,实验现象B中有沉淀出现,则证明有二氧化碳产生,F中溶液均变浑浊,则E中发生一氧化碳还原氧化铜的反应,现象是粉末由黑色变为红色,红色固体生成,则证明有一氧化碳生成;
①根据实验原理生成的金属铜能被氧气氧化,应将装置中的空气排净,注意装置的倒吸现象;
②高锰酸钾具有氧化性,能将氯离子氧化,这样会干扰实验结果,对比三项试验方案得到结论;
根据Fe元素混合计算Fe元素质量,根据质量分数公式计算其质量分数.
解答 解:(1)洗气装置中导气管应该采用“长进短出”原则,符合条件的是A,故选A;
(2)Fe2+易水解导致溶液浑浊,酸能抑制Fe2+水解,为防止亚铁离子水解,应该加入少量稀硫酸;
若要从溶液中得到绿矾FeSO4•7H2O,应该采用蒸发浓缩、冷却结晶、过滤洗涤、干燥操作,
故答案为:防止Fe2+的水解;bcae;
(3)①三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应,根据元素守恒推测得到的产物可能是K2CO3、FeO、Fe、CO2、CO,一氧化碳还原氧化铜,得到的金属铜可被氧气氧化,所以实验开始先通一段时间N2,将装置中的空气排净,实验结束时,为防止倒吸,应该先熄灭酒精灯再通入N2至常温,实验过程中观察到B、F中澄清石灰水都变浑浊,即证明二氧化碳产生,E中有红色固体生成,证明还原性的气体CO的产生,
故答案为:排除装置中的空气,防止干扰实验结果;防止液体回流(或倒吸);CO2、CO;
②在实验方案丙中,先是用盐酸溶解,最后加入高锰酸钾后,高锰酸钾具有氧化性,能将亚铁离子以及氯离子氧化,这样会导致得到的亚铁离子的含量偏高,干扰实验结果,无法确定样品的组成;
甲中样品溶解过程中亚铁离子被氧化生成铁离子,Fe 3+和OH-反应生成Fe(OH)3沉淀,灼烧沉淀得到固体是Fe2O3,
根据Fe原子守恒得n(Fe)=2n[Fe2O3]=2×$\frac{bg}{160g/mol}$=$\frac{b}{80}$mol,
则样品中Fe元素质量分数=$\frac{\frac{b}{80}mol×56g/mol}{ag}$×100%=$\frac{7b}{10a}$×100%,
故答案为:丙方案;使用盐酸溶解样品,氯离子也可以被高锰酸根离子氧化;$\frac{7b}{10a}$×100%.
点评 本题考查物质制备,为高频考点,涉及物质的分离和提纯、实验基本操作、物质的量的有关计算等知识点,明确物质性质、物质性质与其分离提纯方法关系、实验基本操作规范性是解本题关键,易错点是(3)题实验评价,注意:盐酸能被酸性高锰酸钾溶液氧化,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | CuSO4[Cu(OH)2] | B. | NaOH[NaOH] | C. | CuCl2[CuCl2] | D. | NaCl[NaCl] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4 g | B. | 4.8 g | C. | 2.4 g | D. | 1.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在盛有硫酸亚铁铵溶液的试管中,滴加几滴新制氯水,无明显现象,然后滴加KSCN溶液,若观察到溶液变为血红色,则说明硫酸亚铁铵中含有Fe2+ | |
| B. | 测量某溶液的pH,pH试纸一旦用水湿润,一定会产生实验误差 | |
| C. | 灼烧海带可以在坩埚中进行,也可以在蒸发皿中进行 | |
| D. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要小一点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 标准状况下,1mol物质的体积为22.4L | |
| C. | H2、O2、N2、CO2组成的混合气体1mol在标准状况下的体积约为22.4L | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数和原子数都相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com