
【题目】已知有下列转化关系,请回答下列问题(部分反应条件未注明)。
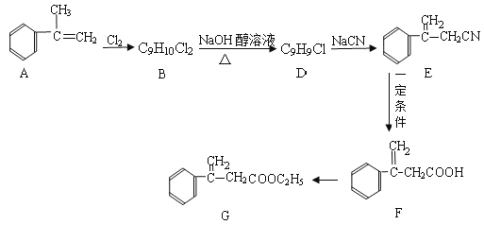
(1)F的官能团名称________________;
(2)B→D的化学反应方程式为____________;
(3)D→E的化学反应类型为_____________________;
(4)F转化为G的化学反应方程式为_________________;
(5)H是F的同分异构体,它是苯的邻位二取代物,遇FeCl3溶液显示特征颜色,则H可能的结构简式为(任写一种)_____。
【答案】碳碳双键、羧基 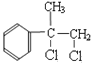 +NaOH
+NaOH![]()
 +NaCl+H2O 取代反应
+NaCl+H2O 取代反应 
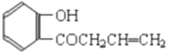 或
或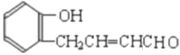 或
或 或
或![]() 等
等
【解析】
A的分子式为C9H10,根据B的分子式可知,A与氯气发生加成反应生成B,B为 ,B在氢氧化钠的醇溶液中发生消去反应生成D,D为
,B在氢氧化钠的醇溶液中发生消去反应生成D,D为 ,据此结合官能团的性质分析解答。
,据此结合官能团的性质分析解答。
(1)F( )的官能团有碳碳双键、羧基,故答案为:碳碳双键、羧基;
)的官能团有碳碳双键、羧基,故答案为:碳碳双键、羧基;
(2)B在氢氧化钠醇溶液中发生消去反应生成D,反应的化学反应方程式为 +NaOH
+NaOH![]()
 +NaCl+H2O,故答案为:
+NaCl+H2O,故答案为: +NaOH
+NaOH![]()
 +NaCl+H2O;
+NaCl+H2O;
(3)根据流程图,D中的氯原子被-CN代替,因此D→E的反应属于取代反应,故答案为:取代反应;
(4)根据流程图,F与乙醇发生酯化反应生成G,反应的化学反应方程式为 ,故答案为:
,故答案为: ;
;
(5)F为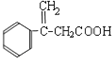 ,H是F的同分异构体,它是苯的邻位二取代物,遇FeCl3溶液显示特征颜色,说明含有酚羟基,H可能的结构简式为
,H是F的同分异构体,它是苯的邻位二取代物,遇FeCl3溶液显示特征颜色,说明含有酚羟基,H可能的结构简式为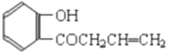 或
或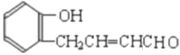 或
或 或
或![]() 等,故答案为:
等,故答案为: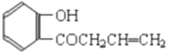 或
或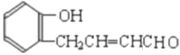 或
或 或
或![]() 等。
等。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为___________________________。
(2)元素C与元素D以原子个数比为1∶1形成化合物Q,请写出Q的电子式为_______。
(3)用电子式表示化合物D2C的形成过程_____________________。
(4)元素A、B、C以原子个数比为4∶2∶3形成化合物W,化合物W中存在的化学键有____________________。
(5)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式为____________,当转移电子为0.2 mol时,标准状况下反应产生气体_______________L。
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZnSO4 受热分解过程中各物质物质的量随温度变化关系如图所示(A、B为含硫的氧化物),下列说法正确的是( )

A.ZnO 属于金属晶体
B.SO3 和 SO2 互为同素异形体
C.物质 A、B 分别是 SO3、SO2
D.700℃~980℃时发生反应的化学方程式为:2ZnSO4![]() 2ZnO+2SO2↑+O2↑
2ZnO+2SO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R 是 6 种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)元素 X 在元素周期表中的位置是_____
(2)元素 M 组成的单质的电子式为_____
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为_________________
(4)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是_____
(5)元素Q、元素 Z 的含量影响钢铁性能,若钢样中元素 Z 以 FeZ 的形式存在,高温下在过量空气中反应生成ZO2和一种红棕色的氧化物,则反应的化学方程式是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)羟基的电子式是__________。
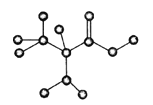
(2)下图是某有机物分子的简易模型,该有机物中含C、H、O、N四种元素。该有机物的分子式为______。
(3)有机物![]() 的键线式为________________;将其在催化剂存在的条件下完全氢化,所得烷烃的系统命名是_____________。
的键线式为________________;将其在催化剂存在的条件下完全氢化,所得烷烃的系统命名是_____________。
(4)苯和液溴反应的化学方程式________。苯酚和NaOH溶液反应的化学方程式__________。
(5)已知某有机物由碳、氢、氧三种元素组成,其相对分子质量为58,取5.8g该有机物在氧气中完全燃烧,将产物依次通过浓硫酸和碱石灰,两者分别增重5.4g和13.2g,回答:该有机物的分子式是_____。若该有机物可使溴水褪色,也能与钠反应,核磁共振氢谱显示该分子中存在四种化学环境不同的氢原子,则该有机物的结构简式可能是______________。
(6)四联苯![]() 的一氯代物有______种。
的一氯代物有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.

(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室制取乙烯的发生装置和验证乙烯性质的实验装置,反应原理为 CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
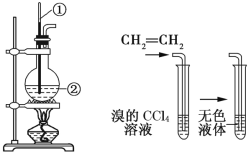
图1 图2
回答下列问题:
(1)图1中仪器①、②的名称分别为_______、_______。
(2)收集乙烯气体最好的方法是__________________。
(3)向溴的CCl4溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于_______(填反应类型),发生反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定含镁3%~5%的铝镁合金中镁的质量分数,设计了2种实验方案,说法不正确的是
方案一:镁铝合金加入足量的氢氧化钠溶液中充分反应后过滤,测定剩余固体质量;
方案二:称量m g铝镁合金粉末,放在图中惰性电热板上,通电使其充分灼烧。测得固体质量增重。

A. 方案一中若称取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥100 mL
B. 方案一中测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,则镁的质量分数偏高
C. 方案二中欲计算镁的质量分数,实验中还需测定灼烧后固体的质量
D. 方案二中若用空气代替O2进行实验,则测定结果偏高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com