
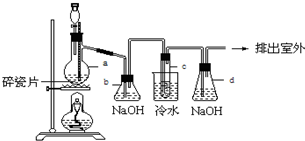
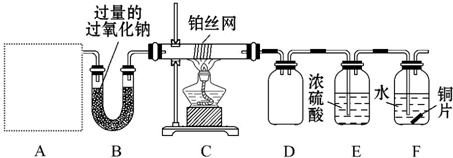
分析 制备1,2-二溴乙烷,由实验装置可知,分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,加热时发生CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,浓硫酸在该反应中作催化剂、脱水剂、吸水剂,b中NaOH溶液可除去乙烯中的酸性物质,c中发生CH2=CH2+Br2→CH2BrCH2Br,冷水冷却后试管中无色液体为1,2-二溴乙烷,d可吸收尾气中的溴,以此来解答.
解答 解:(1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷,发生反应的方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)浓硫酸具有强氧化性,能氧化乙醇,自身被还原成二氧化硫,所以含有杂质气体二氧化碳、二氧化硫,装置b中盛有氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应,
故答案为:吸收乙烯气体中含有的CO2、SO2酸性气体;
(3)浓硫酸在该反应中作催化剂、脱水剂、吸水剂,
故答案为:催化剂、脱水剂、吸水剂.
点评 本题考查制备实验方案的设计,为高频考点,把握有机物的结构与性质、乙烯的制备实验、乙烯的化学性质及实验装置的作用为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 酒精和水:分液 | |
| B. | 淀粉溶液(胶体)中混有氯化钠:用半透膜进行渗析 | |
| C. | 汽油和柴油:分馏 | |
| D. | 三氯甲烷和水:分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(O2)=0.0025 mol/(L•s) | B. | v(NO)=0.008 mol/(L•s) | ||
| C. | v(H2O)=0.003 mol/(L•s) | D. | v(NH3)=0.002 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 )和抗癫痫药物H(
)和抗癫痫药物H(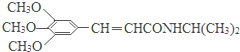 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):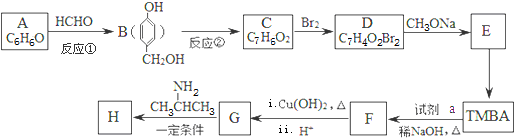
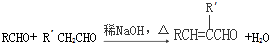 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)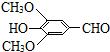 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→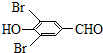 +2HBr.
+2HBr.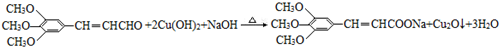 .
.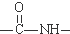 )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 +NaOH→
+NaOH→ +H2NCH(CH3)2.
+H2NCH(CH3)2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
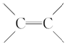 )不能自由旋转,因此
)不能自由旋转,因此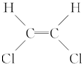 和
和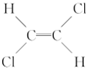 是两种不同的化合物,互为顺反异构体,则分子式为C4H7Cl的烯烃的异构体有( )
是两种不同的化合物,互为顺反异构体,则分子式为C4H7Cl的烯烃的异构体有( )| A. | 12种 | B. | 11种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 115号元素可显+5价 | B. | X原子的中子数与电子数之差为174 | ||
| C. | 115号元素位于周期表第八周期 | D. | 115号元素属于非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL | |
| B. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L | |
| C. | 参加反应的金属的总质量3.6 g<m<9.6 g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 9种 | C. | 12种 | D. | 15种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com