
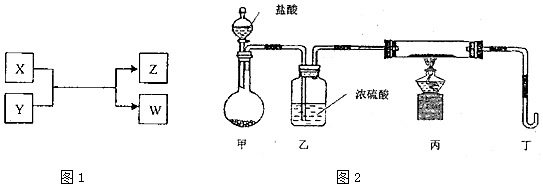
分析 Ⅰ.若W遇淀粉溶液变蓝,w是碘单质,X和Y反应生成碘和Z,Z是生活中常用的调味品,Z是氯化钠,根据元素守恒、氧化还原反应及X和W是单质、Y和Z为化合物知,X是氯气,Y是碘化钠;
Ⅱ.若X是工业上用量最大的金属单质,则X是铁,Z是一种具有磁性的黑色晶体,Z是四氧化三铁,X、Y、Z、W四种物质有如下相互转化关系,其中X、W单质,Y、Z为化合物,该反应是铁和水蒸气反应生成氢气和四氧化三铁,所以W是氢气,Y是水.
(1)高温下,铁和水蒸气反应生成四氧化三铁和氢气;
(2)①从实验安全性方面分析;
②实验过程中要防止杂质的干扰,在实验中要有除杂装置;
(3)先确定溶液中溶质成分,再根据原子守恒计算氢氧化钠的体积.
解答 解:Ⅰ.若W遇淀粉溶液变蓝,w是碘单质,X和Y反应生成碘和Z,Z是生活中常用的调味品,Z是氯化钠,根据元素守恒、氧化还原反应及X和W是单质、Y和Z为化合物知,X是氯气,Y是碘化钠;
①工业上用电解饱和氯化钠溶液制取氢氧化钠,电解方程式为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2NaOH,
故答案为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2NaOH;
②氯气有强氧化性,能把碘离子氧化生成碘酸根离子,同时自身被还原成氯离子,离子方程式为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+,
故答案为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+;
Ⅱ.若X是工业上用量最大的金属单质,则X是铁,Z是一种具有磁性的黑色晶体,Z是四氧化三铁,X、Y、Z、W四种物质有如下相互转化关系,其中X、W单质,Y、Z为化合物,该反应是铁和水蒸气反应生成氢气和四氧化三铁,所以W是氢气,Y是水.
(1)高温条件下,铁和水反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;
(2)①氢气还原氧化物的实验中,因为氢气和氧气在一定范围内会产生爆炸,所以实验应该先制取氢气,然后检验氢气再通入氢气,通入一段时间后再点燃酒精灯,所以实验顺序为b、c、a,故答案为:b c a;
②该反应是放热反应,盐酸检验挥发性,所以制取的氢气中含有氯化氢气体,为防止氯化氢气体干扰实验,应该在甲、乙装置中间增加一个装有水的洗气瓶,洗气氯化氢气体,
故答案为:在甲、乙装置中间增加一个装有水的洗气瓶;
(3)四氧化三铁和硝酸反应生成硝酸盐和NO,向溶液中滴加氢氧化钠溶液,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,根据溶液中硝酸根离子的量计算氢氧化钠的浓度,
硝酸的物质的量=4mol/L×0.05L=0.2mol,充分反应,产生112mL的NO,根据氮原子守恒,硝酸和一氧化氮的物质的量之比为1:1,则溶液中剩余硝酸的物质的量=0.2mol-$\frac{0.112L}{22.4L/mol}$=0.195mol,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,则氢氧化钠和硝酸根离子之间的物质的量之比为1:1,设氢氧化钠的体积为V.
NaOH------NO3-,
1mol 1mol
2V 0.195mol
V=97.5mL,
故答案为:97.5.
点评 本题以元素化合物的推断为载体考查了元素化合物的性质,明确元素化合物性质是解本题的关键,同时考查学生思维能力、分析推断能力,注意(3)题中根据原子守恒计算氢氧化钠的体积较简便,正确确定溶质即可分析解答,难度较大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:计算题
 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mo lCl2参加反应转移电子数一定为2NA | |
| B. | 一定条件下,足量铜与200g98%的浓硫敌充分反应,转移电子数为2NA | |
| C. | 300mL 2mol/L蔗糖溶液中所含蔗糖分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水光照颜色变浅 | |
| B. | 使用排饱和食盐水的方法收集氯气 | |
| C. | H2、I2、HI平衡混合气加压颜色变深 | |
| D. | 把有缺陷的胆矾晶体,投入饱和的硫酸铜溶液,一段时间后,晶体变为规则结构. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
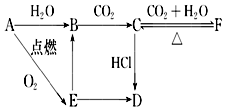 A、B、C、D、E、F六种含有相同元素的物质有如图变化关系,E是淡黄色粉末:
A、B、C、D、E、F六种含有相同元素的物质有如图变化关系,E是淡黄色粉末:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 | |
| B. | 饱和Mg(OH)2溶液与饱和MgF2 溶液相比,前者的c(Mg2+)大 | |
| C. | Mg(OH)2固体在0.01mol/L氨水中的Ksp比在 0.01mol/L NH4Cl 溶液中的Ksp小 | |
| D. | 在Mg(OH)2的悬浊液加入NaF 溶液后,不可能有MgF2沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com