
分析 (1)硫酸为二元酸,盐酸为强酸,醋酸为弱酸;
(2)同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸;
(3)反应速率与氢离子浓度有关,氢离子浓度相同,反应速率相同;由于醋酸在反应过程中电离程度增大,则醋酸与锌反应的平均速率最大;
(4)醋酸为弱酸,稀释过程中醋酸的电离程度增大,则稀释后醋酸中氢离子浓度最大,硫酸和盐酸溶液中氢离子浓度相等.
解答 解:(1)硫酸为二元酸,盐酸为强酸,醋酸为弱酸,则物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c,
故答案为:b>a>c;
(2)同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸,则中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是:b>a=c,
故答案为:b>a=c;
(3)当c(H+)相同、体积相同时,开始时反应速率相同,即:a=b=c;
醋酸完全电离,只有醋酸在继续电离,则醋酸与锌反应的平均速率最快,硫酸和盐酸与锌的反应速率相等,所以分别加入足量锌,产生相同体积的H2(相同状况)反应所需时间:c<a=b,
故答案为:a=b=c;c<a=b;
(4)将c(H+)相同的三种酸均稀释10倍后,醋酸的电离程度增大,则醋酸在稀释后氢离子浓度最大;硫酸和HCl都是强电解质,稀释后二者的c(H+)相等,所以稀释后氢离子浓度由大到小的顺序是:c>a=b,
故答案为:c>a=b.
点评 本题考查弱电解质的电离平衡、化学反应速率的影响因素等知识,题目难度中等,注意掌握影响化学反应速率、电离平衡的因素,明确弱电解质部分电离的特点,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④ | C. | ①②③ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO${\;}_{4}^{2-}$ | B. | CO${\;}_{3}^{2-}$ | C. | Al3+ | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
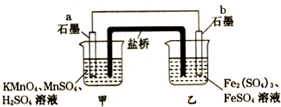 设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )
设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )| A. | 外电路电子的流向是从a到b | |
| B. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| C. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O | |
| D. | 双液原电池工作时产生大量的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.
为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com