
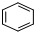
 制取
制取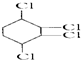 ,
,
 ,则反应的化学方程式为:
,则反应的化学方程式为: 合成
合成 经过两步,可以先将
经过两步,可以先将 与氢气加成,生成氯代环已烷,再消去生成环已烯,再与氯气加成可得,故A为
与氢气加成,生成氯代环已烷,再消去生成环已烯,再与氯气加成可得,故A为 ,B为
,B为 ,模仿A→B→
,模仿A→B→ 的思维方式,可推知C为
的思维方式,可推知C为 ,据此答题.
,据此答题. 合成
合成 经过两步,可以先将
经过两步,可以先将 与氢气加成,生成氯代环已烷,再消去生成环已烯,再与氯气加成可得,故A为
与氢气加成,生成氯代环已烷,再消去生成环已烯,再与氯气加成可得,故A为 ,B为
,B为 ,模仿A→B→
,模仿A→B→ 的思维方式,可推知C为
的思维方式,可推知C为 ,
, 生成
生成 ,是消去反应,
,是消去反应, ;
;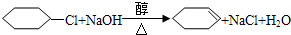 ;⑥
;⑥ ,
, ;
; ;
; ;
; 制取物质
制取物质 ,只要将
,只要将 进行碱性水解即可,反应的化学方程式为
进行碱性水解即可,反应的化学方程式为 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 据报道“全国数以万计的高校、中学化学实验室每天都排放着成分复杂的污染物”.为此我校某化学兴趣小组拟进行如下实验,以粗略测试刚做完实验的实验室(甲)空气中全部酸性气体的含量.
据报道“全国数以万计的高校、中学化学实验室每天都排放着成分复杂的污染物”.为此我校某化学兴趣小组拟进行如下实验,以粗略测试刚做完实验的实验室(甲)空气中全部酸性气体的含量.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、SO42-、Na+、Cl- |
| B、Na+、CO32-、H+、K+ Ba2+ |
| C、Ag+、NO3-、K+、Cl- |
| D、Mg2+、H+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 称量次序 | 加热温度(℃) | 容器+试样质量(g) |
| Ⅰ | 常温 | 62.2 |
| Ⅱ | T1 | 56.8 |
| Ⅲ | T2 | 49.6 |
| Ⅳ | T3 | 44.2 |
| Ⅴ | T4 | 44.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com