


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:江苏省海安县南莫中学2011届高三上学期期中化学试题 题型:022
不同的金属在化学反应中表现出来的活泼程度不同,瑞典化学家贝采里乌斯和俄国化学家贝开托夫称之为金属活动顺序.另一方面,同一金属在不同条件或不同化学反应中也可以表现出不同的活泼程度.
(1)根据金属活动性顺序,工业上冶炼金属可以采用不同的冶炼方法.其中可以用“热分解法”冶炼的金属有________.
(2)
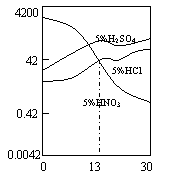
工业上用氯化铁溶液腐蚀铜制电路板.根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序:________.(3)合金Fe-Cr在不同酸中反应情况不同,其在三种稀硫酸、稀硝酸和稀盐酸中的腐蚀速率如图所示,则下列有关说法正确的是________(填写序号).
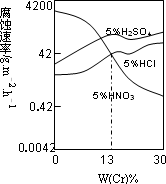
A.酸的氧化性越强,对该合金的腐蚀速率越大
B.稀硝酸对该合金的腐蚀性比另两种酸弱
C.合金中Cr含量增加,稀硝酸对该合金的腐蚀性减弱
(4)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质
(与酸不反应).某化学兴趣小组在实验室条件下,以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收.步骤一:电解精制电解时,粗铜应与电源的________极相连.电解过程中,硫酸铜的浓度会________(填“变大”、“不变”或“变小”).
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:________.
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
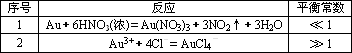
从表中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:________.
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸氢钠(NaHSO4)在水溶液中可以完全电离为Na+和HSO![]() ,HSO
,HSO![]() 在较稀(如1 mol·L-1以下)的溶液中,可完全电离为H+和SO
在较稀(如1 mol·L-1以下)的溶液中,可完全电离为H+和SO![]() 。不过,在浓度大的溶液中HSO
。不过,在浓度大的溶液中HSO![]() 不能完全电离,而是与H+、SO
不能完全电离,而是与H+、SO![]() 共同存在于同一溶液中。
共同存在于同一溶液中。
(1)硫酸氢钠(NaHSO4)所属的物质类别是( )
A.酸 B.盐 C.碱 D.氧化物
(2)NaHSO4溶液的pH 7。(填“>”“<”或“=”=
(3)在稀NaHSO4溶液中加入Na2CO3溶液时,可以得到无色、无味的气体,该气体可以使澄清石灰水变浑浊。写出稀NaHSO4溶液与Na2CO3溶液反应的化学方程式和离子方程式。
查看答案和解析>>
科目:高中化学 来源:2013届福建省南安一中高三上学期期末考试化学试卷(带解析) 题型:实验题
(10分)研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)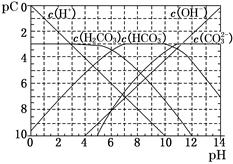
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1 。
。
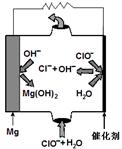
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH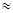 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
| A.变大 | B.变小 | C.基本不变 | D.无法判断 |
 CH3OH(g) +H2O(g) △H ;
CH3OH(g) +H2O(g) △H ;
| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省高三上学期期末考试化学试卷(解析版) 题型:实验题
(10分)研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)

①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1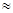 。
。
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH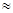 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
A.变大 B.变小 C.基本不变 D.无法判断
(2)高温时,用CO还原MgSO4可制备高纯MgO。由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,
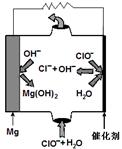
该电池反应的离子方程式为 。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为: CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H
;
CH3OH(g) +H2O(g) △H
;
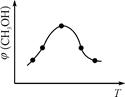
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图
所示,则上述CO2转化为甲醇反应热ΔH 0(填“>” “<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
|
容 器 |
甲 |
乙 |
|
反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中各物质浓度相同,且起始时维持反应逆向进行,则c的取值范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)不同的金属在化学反应中表现出来的活泼程度不同,瑞典化学家贝采里乌斯和俄国化学家贝开托夫称之为金属活动顺序。另一方面,同一金属在不同条件或不同化学反应中也可以表现出不同的活泼程度。
⑴根据金属活动性顺序,工业上冶炼金属可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属有 。
腐蚀速率/g.m-2.h-1
 ⑵工业上用氯化铁溶液腐蚀铜制电路板。根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序: 。
⑵工业上用氯化铁溶液腐蚀铜制电路板。根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序: 。
⑶合金Fe-Cr在不同酸中反应情况不同,其在三种稀硫
酸、稀硝酸和稀盐酸中的腐蚀速率如图所示,则下列
有关说法正确的是 (填写序号)。
A.酸的氧化性越强,对该合金的腐蚀速率越大
B.稀硝酸对该合金的腐蚀性比另两种酸弱
C.合金中Cr含量增加,稀硝酸对该合金的腐蚀性减弱
⑷已知粗铜中含有少量的锌、铁、银、金等金属和少量
|
以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,
并对阳极泥和电解液中金属进行回收。
步骤一:电解精制
电解时,粗铜应与电源的 极相连。电解过程中,硫酸铜的浓度会 (填“变大”、“不变”或“变小”)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl- = AuCl4- | >>1 |
从表中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com