
| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
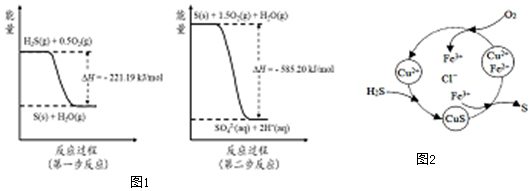
分析 (1)SO2的大量排放会形成酸雨,二氧化硫为酸性氧化物与水生成亚硫酸,亚硫酸为弱电解质,部分电离产生氢离子与亚硫酸氢根离子;
(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJ•mol-1;
第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJ•mol-1;
依据盖斯定律计算反应热;
(3)①0-4min二氧化硫物质的量变化为0.10mol-0.050mol=0.050mol,反应速率v=$\frac{△c}{△t}$;
②结合图表数据,5min时n(O2)=$\frac{0.10mol-0.04mol}{2}$=0.03mol,剩余氧气物质的量=0.05mol-0.03mol=0.02mol,6min时氧气物质的量为0.02mol,说明5分钟反应达到平衡状态,结合化学平衡三行计算列式计算平衡浓度,平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
③计算此时浓度商和平衡常数比较分析判断平衡进行方向;
(4)根据使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质进行分析;反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq),反应的平衡常数K=$\frac{c(C{u}^{2+})c({H}_{2}S)}{{c}^{2}({H}^{+})}$=$\frac{c(C{u}^{2+})c({S}^{2-})c({H}_{2}S)c(H{S}^{-})}{c({S}^{2-})c({H}^{+})c(H{S}^{-})c({H}^{+})}$=$\frac{Ksp(CuS)}{K{a}_{1}K{a}_{2}}$;
解答 解:(1)SO2的大量排放会引起严重的环境问题是形成酸雨,二氧化硫为酸性氧化物与水生成亚硫酸,亚硫酸为弱电解质,部分电离产生氢离子与亚硫酸氢根离子,离子方程式:SO2+H2O?H2SO3;H2SO3?H++HSO3-,
故答案为:酸雨;SO2+H2O?H2SO3;H2SO3?H++HSO3-;
(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJ•mol-1;
第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJ•mol-1;
依据盖斯定律,第一步与第二步方程式相加得:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJ•mol-1;
故答案为:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJ•mol-1 ;
(3)①0-4min二氧化硫物质的量变化为0.10mol-0.050mol=0.050mol,反应速率v=$\frac{\frac{0.050mol}{2L}}{4min}$=6.25×10-3mol/(L•min),故答案为:6.25×10-3mol/(L•min);
②结合图表数据,5min时n(O2)=$\frac{0.10mol-0.04mol}{2}$=0.03mol,剩余氧气物质的量=0.05mol-0.03mol=0.02mol,6min时氧气物质的量为0.02mol,说明5分钟反应达到平衡状态,结合化学平衡三行计算列式计算平衡浓度,5min时,
2SO2(g)+O2(g)?2SO3(g),
起始量(mol) 0.1 0.05 0
变化量(mol) 0.06 0.03 0.06
平衡量(mol) 0.04 0.02 0.06
平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{(\frac{0.06}{2})^{2}}{(\frac{0.04}{2})^{2}×\frac{0.02}{2}}$=225(mol/L)
故答案为:225(mol/L);
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),Qc=$\frac{(\frac{0.06}{2})^{2}}{(\frac{0.04+0.02}{2})^{2}\frac{(0.02+0.01)}{2}}$=$\frac{200}{3}$=66.67<K,反应正向进行,平衡移动程度小重新达到平衡时混合气体中SO2的百分含量将减小,故答案为:减小;
(4)①使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质,所以氧气必须过量,采取的措施是:增大混合气体中空气的比例,通入足量的空气,
故答案为:通入足量的空气;
②反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq),反应的平衡常数K=$\frac{c(C{u}^{2+})c({H}_{2}S)}{{c}^{2}({H}^{+})}$=$\frac{c(C{u}^{2+})c({S}^{2-})c({H}_{2}S)c(H{S}^{-})}{c({S}^{2-})c({H}^{+})c(H{S}^{-})c({H}^{+})}$=$\frac{Ksp(CuS)}{K{a}_{1}K{a}_{2}}$=$\frac{6.3×1{0}^{-36}}{1.3×1{0}^{-7}×7.1×1{0}^{-15}}$=6.83×10-15<10-5,反应很难进行,
故答案为:反应很难进行;
点评 本题考查了物质性质、热化学方程式书写、化学平衡计算、化学平衡常数和反应速率概念计算、影响平衡的因素判断,溶度积常数的计算等知识点,掌握基础是解题关键,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol•L-1的NaOH标准溶液 | |
| B. | 催化剂可以加快化学反应速率但不能改变化学反应的焓变 | |
| C. | 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 | |
| D. | 对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1mL饱和氯化铁溶液逐滴加入到20mL温水中,边加边搅拌 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体和溶液 | |
| D. | 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
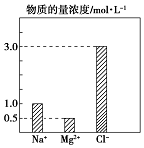 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 仔细观察坐标图 | 肯定无 CO32- | 肯定无该离子的理由碳酸根离子和镁离子之间会反应 |
| 步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 Fe3+ | 肯定无该离子的理由该离子为黄色 |
| 步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42-、H+;肯定无Ba2+ | 肯定有H+的理由电荷守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com