
| A、任何浓度溶液的酸碱性都可用pH试纸测定 | B、某温度下,pH=6.2的纯水显酸性 | C、25℃时,pH=1的醋酸溶液中c(H+)是pH=2的盐酸溶液中c(H+)的10倍 | D、25℃时,pH=12的NaOH溶液中的n(OH-)=10-2mol |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
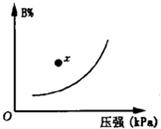 可逆反应mA(s)+nB(g)?pC(g);△H<0.在一定温度下,平衡时B的体积分数(B%)与压强的关系如图所示,下列叙述中一定正确的是( )
可逆反应mA(s)+nB(g)?pC(g);△H<0.在一定温度下,平衡时B的体积分数(B%)与压强的关系如图所示,下列叙述中一定正确的是( )| A、m+n>p | B、升高温度平衡向正反应方向移动 | C、x点时正反应速率大于逆反应速率 | D、升高温度,逆反应速率增大,正反应速率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com