
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s) ΔH=-235.8 kJ·mol-1。
已知2Ag2O(s)===4Ag(s)+O2(g) ΔH=+62.2 kJ·mol-1,则O3转化为O2的热化学方程式为________________;
②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为________________________
________________________________________________。
(2)用活性炭还原法处理氮氧化物,有关反应为C(s)+2NO(g)N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1 ℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
①10 min~20 min以v(CO2)表示的反应速率为______;
②根据表中数据,计算T1 ℃时该反应的平衡常数为______(保留两位小数);
③下列各项能作为判断该反应达到平衡标志的是______(填序号字母);
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是________;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率________(填“增大”、“不变”或“减小”)。
科目:高中化学 来源: 题型:
某化学兴趣小组对加碘食盐中碘酸钾进行研究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取W g加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.00×10-3 mol·L-1的Na2S2O3标准溶液滴定。
(已知:IO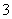 +5I-+6H+===3I2+3H2O,I2+2S2O
+5I-+6H+===3I2+3H2O,I2+2S2O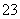 ===2I-+S4O
===2I-+S4O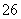 )
)
滴定时Na2S2O3溶液应放在________(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是____________mg·kg-1(以含W的代数式表示)。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl, 加蒸馏水溶解 | 溶液无变化 |
| ② | 滴加淀粉KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加稀H2SO4溶液,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因:__________;根据学生乙的实验结果,请对学生甲的实验结果作出简要评价____________________。
(3)工业上通常用电解KI溶液的方法来制备碘酸钾,电解过程中请你帮助学生丙设计实验来判断电解是否完全。仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸。
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列实验现象得出的结论正确的是( )
| 选项 | 实验现象 | 结论 |
| A | 将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
| B | 某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定存在SO |
| C | 滴有酚酞的Na2CO3溶液中加入BaCl2固体,红色变浅 | Na2CO3溶液中存在水解平衡 |
| D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:________________________________________________________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②Ⅳ中检验Cl2的实验方法:_________________________________________________。
③与Ⅱ对比,得出的结论(写出两点):________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一种碳纳米管能够吸附氢气,可做二次电池(如下图所示)的碳电极。该电池的电解质为6 mol·L-1 KOH溶液,下列说法中正确的是( )
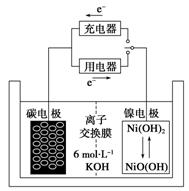
A.充电时阴极发生氧化反应
B.充电时将碳电极与电源的正极相连
C.放电时碳电极反应为H2-2e-===2H+
D.放电时镍电极反应为NiO(OH)+H2O+e-===Ni(OH)2+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1 mol CH4(g)和2 mol O2(g)的能量总和小于1 mol CO2(g)和2 mol H2O(g)的能量总和
B.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
C.1 mol Fe在氧气中充分燃烧失去3NA个电子
D.在标准状况下,NA个CHCl3分子所占的体积约为 22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸工业中,SO2转化为SO3是一个关键步骤。
(1)某温度下,SO2(g)+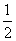 O2(g)SO3(g) ΔH=-98 kJ·mol-1。开始时在1.00 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时放出热量196 kJ,该温度下平衡常数K=________。
O2(g)SO3(g) ΔH=-98 kJ·mol-1。开始时在1.00 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时放出热量196 kJ,该温度下平衡常数K=________。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持温度和容器内压强不变,充入1 mol SO3
E.保持容器体积不变,升高混合气体温度
F.移动活塞压缩气体
(3)下列关于2SO2(g)+O2(g)2SO3(g)反应的图像中,正确的是________(填字母)。

(4)SO2既有氧化性又有还原性,还有漂白性。将SO2气体通入酸性KMnO4溶液中,溶液褪色,SO2表现________性,其中氧化剂和还原剂的物质的量之比为________(已知KMnO4酸性条件下的还原产物为Mn2+)。
(5)某人设想以下图装置生产硫酸,写出a电极的电极反应式________________。检验SO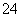 的具体操作为__________。
的具体操作为__________。
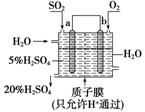
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室进行NaCl溶液蒸发时,一般有以下操作过程
①放置酒精灯
②固定铁圈位置
③放上蒸发皿
④加热搅拌
⑤停止加热、余热蒸干,其正确的操作顺序为( )
A.②③④⑤
B.①②③④⑤
C.②③①④⑤
D.②①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在以下所列各对化合物中,可看作高分子化合物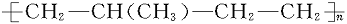 的单体的是 ( )
的单体的是 ( )
A.CH3—CH=CH2和CH2 CH—CH=CH2
CH—CH=CH2
B.CH2=CH2和CH2=CH—CH=CH2
C.CH3—CH2—CH=CH2和CH2=CH—CH3
D.CH2=CH2和CH2=CH—CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com