
| 选项 | 操作 | 实验现象 | 结论 |
| A | 向NaBr溶液中加入氯水,再加入淀粉KI溶液 | 溶液变蓝 | 氧化性:Cl2>Br2>I2 |
| B | 将铝片放入盐酸中 | 产生气泡的速率开始较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| C | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜悬浊液,加热 | 得到蓝色溶液 | 蔗糖水解产物没有还原性 或蔗糖未水解 |
| D | 向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液 | 品红溶液褪色 | 气体中含有Cl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Cl2能氧化溴离子、碘离子分别生成Br2、I2,I2能使淀粉试液变蓝色;
B.将铝片放入盐酸中,开始较慢,则开始发生氧化铝与酸的反应;
C.葡萄糖和新制氢氧化铜悬浊液的氧化反应必须在碱性条件下进行;
D.向漂白粉中滴入稀硫酸,发生氧化还原反应,生成气体为氯气.
解答 解:A.向NaBr溶液中加入氯水,置换出溴,再加入淀粉KI溶液,由现象可知,溴置换出碘,若加氯水过量,氯水可氧化KI,则不能说明氧化性Br2>I2,故A不选;
B.将铝片放入盐酸中,开始较慢,则开始发生氧化铝与酸的反应,而随后加快,后来又逐渐减慢,与氢离子浓度有关,故B不选;
C.水解产物葡萄糖具有还原性,水解后在碱性溶液中与氢氧化铜反应生成砖红色沉淀,可说明葡萄糖的还原性,故C不选;
D.向漂白粉中滴入稀硫酸,发生氧化还原反应,生成气体为氯气,则品红溶液褪色,故D选;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化还原反应、影响反应速率的因素、有机物结构与性质、漂白性等,明确反应原理、物质的性质为解答的关键,注意C中反应条件及B中隐含信息,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 贮氢金属并不是简单地吸附氢气,而是通过化学反应贮存氢气 | |
| B. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及生物质能的利用 | |
| C. | 煤的主要成分为单质碳、苯、二甲苯等,因而可通过煤的干馏将它们分离 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论或解释 |
| A | 用pH计或pH试纸分别测定饱和SO2水溶液和饱和CO2水溶液的pH值 | 饱和SO2水溶液的pH值小于饱和CO2水溶液 | 亚硫酸强于碳酸 |
| B | 向加热KClO3制氧气后的残余固体中加入浓H2SO4,继续加热 | 产生黄绿色气体 | 浓硫酸与残渣中的KCl发生反应生成了Cl2 |
| C | 加热装在试管中的NH4Cl晶体 | 试管底部的晶体消失,试管上部有晶体凝结. | NH4Cl晶体发生了升华. |
| D | 将一根较粗的铜丝在酒精灯火焰上加热到红热,然后趁热插入乙醇中一会儿取出. | 铜丝先变黑后又变红,乙醇中伴有刺激性气味产生. | 铜丝发生了几个反应,但铜丝前后的质量不变. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
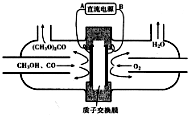
| A. | 外电源负极为A极 | |
| B. | 阳极的电极反应:2CH3OH+CO-2e-═(CH3O)2CO+2H+ | |
| C. | H+从右向左通过质子交换膜 | |
| D. | 电解槽中添加少量烧碱有利于导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{NaNO_{2}}{→}$
$\stackrel{NaNO_{2}}{→}$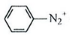


 .
. .D→E的反应类型是氧化反应.
.D→E的反应类型是氧化反应. )也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有3种,写出一种X可能的结构简式
)也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有3种,写出一种X可能的结构简式 (邻、间、对位置均可).
(邻、间、对位置均可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
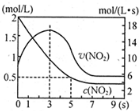 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: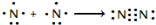 .
.| 化学键 | N-H | N-N | N=N | N≡N | O=O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
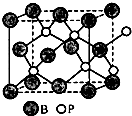 X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.
X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.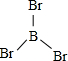 .
.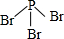 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
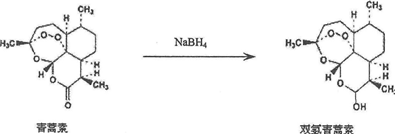
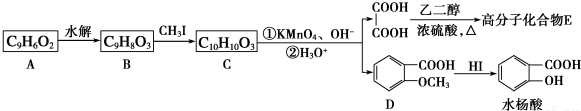
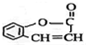 .
.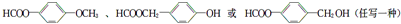 .
.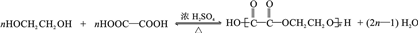 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com