
| ||
| △t |
| ||
| 20s |
| 0.1mol×(1-20%) |
| 2L |
| 0.02mol |
| 2L |
| c(WI2) |
| c(I2) |
| 0.01mol/L |
| 0.04mol/L |
| (0.2-x)mol |
| 2L |
| xmol |
| 2L |
| ||
|
| 0.1mol×(1-20%)+0.02mol |
| 2L |
| 0.1mol×20%+0.02mol |
| 2L |
| 0.02mol/L |
| 0.05mol/L |


科目:高中化学 来源:不详 题型:多选题
| A.混合溶液中由水电离出的c(OH-)=1×10-8mol/L |
| B.混合溶液中c(Na+)=c(X-)+c(HX) |
| C.混合溶液中c(Na+)-c(X-)=c(OH-)-c(H+) |
| D.混合溶液中c(X-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H1<△H2 | B.△H1>△H2 | C.△H1=△H2 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.1:3 | C.1:4 | D.2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.v(NH3)=0.2mol/(L?s) | B.v(N2)=1.0mol/(L?min) |
| C.v(H2)=1.67mol/(L?min) | D.v(H2)=0.3mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.v(NH3)=0.2mol/(L?min) | B.v(N2)=1mol/(L?min) |
| C.v(H2)=1.67mol/(L?min) | D.v(H2)=1.37mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等于0.6mol/L | B.小于0.6mol/L |
| C.等于0.8mol/L | D.大于0.8mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
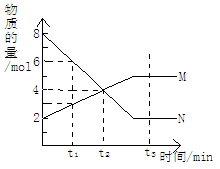
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
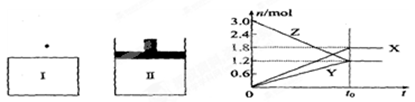
A.该反应的化学方程式为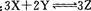 |
| B.若两容器中均达到平衡后,两容器的体积V(I)<V(Ⅱ),则容器Ⅱ达到平衡所用时间小于t。 |
| C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D.达平衡后,若对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com