
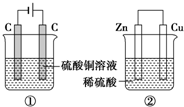
 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:分析 ①中加入19.6gCu(OH)2固体,n(Cu(OH)2)=$\frac{19.6g}{98g/mol}$=0.2mol,Cu(OH)2从组成上可看成CuO•H2O,加入0.2mol Cu(OH)2后恰好恢复到电解前的浓2H2↑+O2↑ 可知电解过程中共转移电子为0.8mol;②为原电池装置,Zn为负极,发生Zn-2e-=Zn2+,Cu为正极,发生2H++2e-=H2↑,以此解答该题.
解答 解:①中加入19.6gCu(OH)2固体,n(Cu(OH)2)=$\frac{19.6g}{98g/mol}$=0.2mol,Cu(OH)2从组成上可看成CuO•H2O,加入0.2mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.2 mol H2SO4,并消耗0.2mol H2O,由电解的总反应式为:2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ 可知电解过程中共转移电子为0.8mol,
(1)由2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 可知,电解生成0.2 mol H2SO4,同时生成0.1molO2,电解0.2mol H2O,生成0.3mol气体,则体积为(0.1+0.3)mol×22.4L/mol=8.96L,故答案为:8.96;
(2)①由2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 可知生成0.2molCu,则阴极质量增加0.2mol×64g/mool=12.8g,故答案为:12.8;
②两个装置,工作时转移的电子数相等,即转移0.8mol电子,则消耗0.4molZn,质量为0.4mol×65g/mol=26g,故答案为:26;
(3)①中电解生成了0.2 mol H2SO4,则c(H+)=0.4mol/L,pH=-lg0.4=-2×0.3+1=0.4,故答案为:0.4;
(4)甲醛被氧化生成碳酸根离子,电极方程式为HCHO-4e-+6OH-=CO32-+4H2O,因转移0.8mol电子,则消耗0.2mol甲醛,分子数为0.2NA(或1.204×1023),故答案为:HCHO-4e-+6OH-=CO32-+4H2O;0.2NA(或1.204×1023).
点评 本题是拼合型题目,涉及原电池、电解池等,题目综合性较大,难度较大,①中电子转移数目计算为易错点、难点,注意把握电极方程式的书写,为解答该题的关键,要求学生具有分析和解决问题的能力.


科目:高中化学 来源: 题型:多选题
| A. | aL气体的平均相对分子质数为41.3 | |
| B. | aL气体被水吸收时转移电子的物质的量为($\frac{2m}{170}-\frac{b}{108}$)mol | |
| C. | cL剩余气体是O2,且c=$\frac{a}{4}$ | |
| D. | 将mgAgNO3溶于水,再加足量的盐酸,$\frac{b}{108}$×143.5g可生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| D. | 酸式滴定管尖嘴部分开始实验时有气泡,滴定后无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
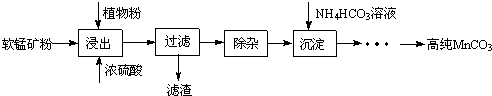
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ正=υ逆≠0时的状态 | B. | NO2全部转变成N2O4的状态 | ||
| C. | c(NO2)=c(N2O4)的状态 | D. | 体系的颜色发生变化的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.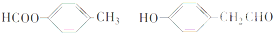 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al>Mg>Na>H | B. | 热稳定性:NH3>PH3>H2S>HCl | ||
| C. | 元素非金属性:F>O>N>C | D. | 酸性:HClO4>H2SiO3>H3PO4>H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过植物的光合作用,太阳能转化为热能 | |
| B. | 使用电炉加热食物,将电能转化为化学能 | |
| C. | 生物体内化学变化的过程在能量转化上比在体外发生的一些能量转化更为合理、有效 | |
| D. | 燃料燃烧,只是将化学能转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
| A. | X、N元素的金属性:X>N | |
| B. | Y、M元素形成的离子化合物是工业冶炼Y的原料 | |
| C. | X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子 | |
| D. | 表中Z元素的最高价氧化物的水化物的分子式可表示为H3ZO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com