
| A.称量时,应将NaOH固体直接放在托盘天平的左盘上 |
| B.将称好的NaOH固体放入烧杯中,加入少量水溶解 |
| C.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中 |
| D.定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
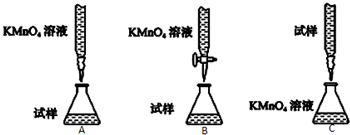
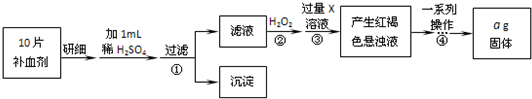
查看答案和解析>>
科目:高中化学 来源: 题型:
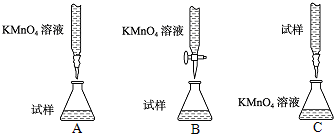
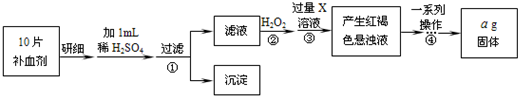
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③ | C、①②④ | D、②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com