
【题目】某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油. 请回答下列问题:
(1)加入浓HNO3前应先通一段时间N2 , 具体操作为: , 其作用是 .
(2)关闭K1、K2 , 打开K3 , 通过分液漏斗向试管中加入一定量的浓硝酸,然后在硝酸上方加一层煤油,煤油的作用是 , 待铜和硝酸反应完毕后,通过分液漏斗向试管中加煤油直至试管充满.
(3)读取量气管读数时,要先 , 然后再读取读数.
(4)数据分析:①从B中取20mL溶液,恰好中和用去0.lmol/L的NaOH体积为16mL则B中所得硝酸的物质的量浓度为 . ②假设只生成NO2 , 通过计算理论上收集到的气体体积为mL (标准状况下).
③实验最终测得气体的体积为130.5mL(标准状况下),与理论值有差异,其理由可能为 .
A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO
B.过程中还发生了反应4NO+3O2+2H2O=4HNO3
C.过程中还发生了反应4NO2+O2+2H2O=4HNO3
D.硝酸具有挥发性,对实验有影响.
【答案】
(1)关闭K3,打开K1、K2通入N2 ;排尽装置内的空气,以防氧化可能生成的NO
(2)液封,防正硝酸挥发
(3)向下移动量气管D,调整液面使C、D 中液面相平
(4)0.08mol/L;121.68; A
【解析】解:(1)由装置图可知N2从K3进,空气从K1排出,所以要关闭 K2,打开K1、K3;NO易被空气中的氧气氧化,所以要先用氮气排净装置中的空气;所以答案是:关闭K3,打开K1、K2;排尽装置内的空气,以防氧化可能生成的NO;(2)硝酸属于挥发性酸,煤油的密度小在硝酸上面,能防止硝酸挥发,所以在硝酸中加煤油的作用为液封,防正硝酸挥发;所以答案是:液封,防正硝酸挥发;(3)读数时要保持左右气体压强相等,以减少误差,即保持两边液面相平,还要用眼睛平视读数,即向下移动量气管D,调整液面使C、D 中液面相平;所以答案是:向下移动量气管D,调整液面使C、D 中液面相平;(4)①B中溶液为硝酸,与氢氧化钠等物质的量反应,从B中取20mL溶液,恰好中和用去0.lmol/L的NaOH体积为16mL,则c(硝酸)= ![]() =0.08mol/L;所以答案是:0.08mol/L;②B中发生的反应为3NO2+H2O=2HNO3+NO,B中溶液的体积为80mL,则B中硝酸的物质的量为0.08L×0.08mol/L=0.0064mol,所以NO的体积为0.0064mol×
=0.08mol/L;所以答案是:0.08mol/L;②B中发生的反应为3NO2+H2O=2HNO3+NO,B中溶液的体积为80mL,则B中硝酸的物质的量为0.08L×0.08mol/L=0.0064mol,所以NO的体积为0.0064mol× ![]() ×22.4L/mol=0.07168L,由于A中残留N2为50mL,也被全部排到量气管中,所以理论上收集到的气体体积为71.68+50=121.68mL;所以答案是:121.68;③A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO,生成NO时,量气管中NO偏多,实验最终测得气体的体积为130.5mL比理论值偏大,故A正确;B.过程中还发生了反应4NO+3O2+2H2O=4HNO3,则量气管中NO偏少,而实验最终测得气体的体积为130.5mL比理论值偏大,故B错误;C.过程中还发生了反应4NO2+O2+2H2O=4HNO3,则量气管中NO偏少,实验最终测得气体的体积为130.5mL比理论值偏大,故C错误;D.实验中加了煤油,排除了硝酸挥发性的影响,实验值与理论值相近,故D错误;所以答案是:A.
×22.4L/mol=0.07168L,由于A中残留N2为50mL,也被全部排到量气管中,所以理论上收集到的气体体积为71.68+50=121.68mL;所以答案是:121.68;③A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO,生成NO时,量气管中NO偏多,实验最终测得气体的体积为130.5mL比理论值偏大,故A正确;B.过程中还发生了反应4NO+3O2+2H2O=4HNO3,则量气管中NO偏少,而实验最终测得气体的体积为130.5mL比理论值偏大,故B错误;C.过程中还发生了反应4NO2+O2+2H2O=4HNO3,则量气管中NO偏少,实验最终测得气体的体积为130.5mL比理论值偏大,故C错误;D.实验中加了煤油,排除了硝酸挥发性的影响,实验值与理论值相近,故D错误;所以答案是:A.


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下: 
①用量筒量取50mL 0.50molL﹣1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL 0.55molL﹣1 NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)倒入NaOH溶液的正确操作是(填序号).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1molL﹣1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3 , 则△H1、△H2、△H3的大小关系为 .
(5)(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应H2(g)+I2(g)2HI(g),0~5min内H2的浓度减少了0.1mol/L,则在这段时间内
用HI表示的平均反应速率为( )
A.0.01molL﹣1min﹣1
B.0.04molL﹣1min﹣1
C.0.2molL﹣1min﹣1
D.0.5molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取氨气并完成喷泉实验(图中夹持装置均已略去). 
(1)写出实验室制取氨气的化学方程式 .
(2)收集氨气应使用法,要得到干燥的氨气可选用作干燥剂.
(3)用图Ⅰ所示装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发喷泉的操作是 , 该实验的原理是 .
(4)如果只提供如图Ⅱ所示装置,请说明引发喷泉的方法是
(5)写出氨气催化氧化的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示。
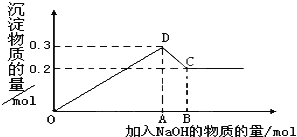
(1)写出下列线段内发生反应的方程式:
OD段__________________________________。
CD段__________________________________。
(2)图中C点表示加入________mol NaOH时。
(3)原溶液中来自MgCl2、AlCl3 的氯离子物质的量浓度之比为_____________。
(4)图中线段OB:OA=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为: .
(2)在一定体积的10molL﹣1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积(填“大于”、“等于”或“小于”)180mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 .
(3)欲迅速除去铝壶底部的水垢,又不损坏铝壶,最好的方法是
A.浓盐酸
B.稀硝酸
C.冷的浓硝酸
D.冷的浓硫酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温恒容密闭容器中充入1mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
A.反应进行到3 min时,该反应达到平衡状态
B.从反应开始到平衡,CO2的转化率为25%
C.第3 min时,氢气的平均反应速率为1.5mol/(L?min)
D.该温度下,反应的平衡常数的值为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:Ksp(AgCl)=1.8×10-10 , Ksp(AgI)=1.5×10-16 , Ksp(Ag2CrO4)=2.0×10-12 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl >AgI> Ag2CrO4
B.AgCl> Ag2CrO4 >AgI
C.Ag2CrO4>AgCl >AgI
D.Ag2CrO4>AgI >AgCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com