
| A. | ① | B. | ①③ | C. | ②④⑤⑥⑦ | D. | ①③⑤ |
分析 ①核外电子排布相同的离子,核电核数越大,离子半径越大,离子的电子层数越多,离子半径越大;
②元素的非金属性越强,对应的氢化物越稳定;
③元素的非金属性越强,对应阴离子的还原性越弱;
④非金属性由强到弱顺序:Cl>S>Se>Te,所以氧化性顺序:Cl2>S>Se>Te;
⑤元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
⑥同周期元素从左到右元素的非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱;
⑦同周期元素从左到右元素的逐渐减弱,同主族元素从上到下元素的金属性逐渐增强.
解答 解:①K+、Cl-原子核外电子排布相同,核电核数Cl-<K+,则半径Cl->K+,离子的原子核外电子层数越多,半径越大,核外电子层数最小,则半径最小,则有Cl->K+>Al3+,故错误;
②非金属性:F>Cl>S>P>Si,元素的非金属性越强,对应的氢化物越稳定,则氢化物的稳定性:HF>HCl>H2S>PH3>SiH4,故正确;
③非金属性:F>Cl>Br>I>S,元素的非金属性越强,对应阴离子的还原性越弱,则还原性:F-<Cl-<Br-<I-<S2-,故错误;
④非金属性由强到弱顺序:Cl>S>Se>Te,所以氧化性顺序:Cl2>S>Se>Te,故正确;
⑤非金属性:S>P>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,次氯酸的酸性比碳酸酸性弱,则酸性:H2SO4>H3PO4>H2CO3>HClO,故正确;
⑥因同周期元素从左到右元素的非金属性逐渐增强,则有O>N、P>Si,同主族元素从上到下元素的非金属性逐渐减弱,则N>P,所以有非金属性:O>N>P>Si,故正确;
⑦同周期元素从左到右元素的逐渐减弱,则金属性Ca<K,同主族元素从上到下元素的金属性逐渐增强,则金属性Be<Mg<Ca,所以金属性:Be<Mg<Ca<K,故正确.
故选:B.
点评 本题考查了微粒半径大小的比较,元素非金属性强弱判断依据,题目难度不大,解题时关键是根据元素周期表和周期律判断出元素非金属性强弱.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸的反应 OH-+H+═H2O | |
| B. | 氧化钙与稀盐酸反应 CaO+2H+═Ca2++H2O | |
| C. | 铁片插入硝酸银溶液中 Fe+Ag+═Fe2++Ag | |
| D. | 碳酸钙溶于稀硝酸中 CO32-+2H+═CO2↑+Η2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中燃烧,能产生黑烟 | B. | 分子中只含有极性共价键 | ||
| C. | 分子中C、H元素的质量为1:1 | D. | 通入氢气即可发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
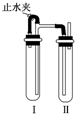 实验室制备Fe(OH)2沉淀时,由于其在空气中极易发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3.(填化学方程式)而很难观察到沉淀的颜色.为制得Fe(OH)2白色沉淀,有人设计了如图所示的装置,用NaOH溶液、铁屑、稀H2SO4等试剂制备.实验时试管Ⅰ里应加入稀H2SO4和铁屑(填试剂名称).在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹.
实验室制备Fe(OH)2沉淀时,由于其在空气中极易发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3.(填化学方程式)而很难观察到沉淀的颜色.为制得Fe(OH)2白色沉淀,有人设计了如图所示的装置,用NaOH溶液、铁屑、稀H2SO4等试剂制备.实验时试管Ⅰ里应加入稀H2SO4和铁屑(填试剂名称).在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数之比为1:1 | B. | 密度之比为3:2 | ||
| C. | 质量之比为7:11 | D. | 质子数之比为7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液1 mL稀释至100 mL后,pH等于3 | |
| B. | 向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 | |
| C. | 该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12 | |
| D. | 该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | NH4HSO4溶液与过量NaOH稀溶液反应:NH4++OH-=NH3•H2O | |
| D. | FeBr2溶液中通入少量Cl2:2Fe2++2Br-+Cl2=2Fe3++Br2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com