
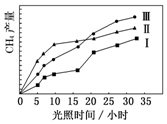
 利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.
利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.分析 (1)相同时间甲烷的物质的量的变化量越大,表明平均速率越大,相同时间甲烷的物质的量的变化量越小,平均反应速率越小.由图2可知反应开始后的12小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多;
(2)①CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的△H=+206kJ•mol-1,反应是吸热反应,反应物能量低于生成物能量;依据能量变化画出图象;
②依据合成平衡三段式列式计算得到转化率.
解答 解:(1)由图2可知,在0~30h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅱ)<△n(Ⅲ),故在0~30h内,CH4的平均生成速率v(Ⅲ)>v(Ⅱ)>v(Ⅰ);
由图2可知反应开始后的12小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多;
故答案为:VⅢ>VⅡ>VⅠ;Ⅱ;
(2)①CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的△H=+206kJ•mol-1,反应是吸热反应,反应过程中体系的能量变化图为: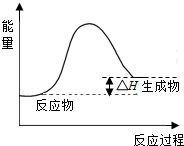 .
.
答:反应过程中体系能量变化图为 ;
;
②将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,根据平衡的三步计算可求CH4的平衡转化率:
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol) x x 0 0
变化量(mol) 0.10 0.10 0.10 0.30
平衡量(mol) x-0.10 x-0.10 0.10 0.30
K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$=$\frac{0.10×0.3{0}^{3}}{(x-0.10)^{2}}$=27
计算得到x=0.11mol
甲烷的转化率=$\frac{0.10}{0.11}$×100%=91%
答:CH4的平衡转化率为91%.
点评 本题综合考查化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算鞥里,题目涉及图象分析和画图象的方法,平衡计算应用,热化学方程式的书写原则和盖斯定律的计算应用,题目难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
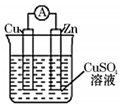
| A. | 锌棒为负极 | B. | 锌棒发生氧化反应 | ||
| C. | 反应后铜棒质量增重 | D. | 电子从铜棒经外电路流向锌棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含Cl2和H2O分子 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡放出,该气体是O2 | |
| D. | 氯水放置数天后酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯银器的表面在空气中因化学腐蚀渐渐变暗 | |
| B. | 当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 1 mol•L-1NaCl溶液中含有的Cl-数目为NA | |
| C. | 28 g N2和N4组成的混合气体中含有的原子数为2 NA | |
| D. | 2.4 g Mg与足量盐酸反应,转移的电子数目为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com