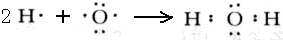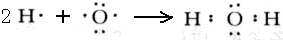X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电子数;Y与Z同主族;XY
2是非极性分子,其晶体可用作人工降雨.请回答:
(1)写出XY
2分子的电子式
.
(2)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为
H2SO4
H2SO4
.
工业制造W的生产过程主要分为三个阶段.
①在 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式
S(s)+O2(g)=SO2(g);△H=-297kJ?mol-1;
S(s)+O2(g)=SO2(g);△H=-297kJ?mol-1;
.
②在接触氧化阶段,为提高ZY
2的转化率,从理论上判断,应选择的条件是低温和高压.从下表给出不同温度、压强下ZY
2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择的适合的温度和压强是
B
B
(选填字母).
A.400℃~500℃10MPa
B.400℃~500℃1MPa
C.500℃~500℃10MPa
D.400℃~500℃0.1MPa
压强/MPa
转化率/%
温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 |
99.2 |
99.6 |
99.7 |
99.9 |
| 500 |
93.5 |
96.9 |
97.8 |
99.3 |
| 600 |
73.7 |
85.8 |
89.5 |
96.4 |
③在吸收阶段,为尽可能提高ZY
3的吸收效率,工业上选择的吸收剂是(选填字母)
C
C
.
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(3)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
.
②500℃,11.2L(标准状况)ZY
2在催化剂作用下与XY发生化学反应.若有2×6.02×10
23个电子转移时,该反应的化学方程式是
.



 .
. .
.

 名校课堂系列答案
名校课堂系列答案