
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是_______,ΔH3=_______kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)2NH3(g)
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(ψ)如图所示。
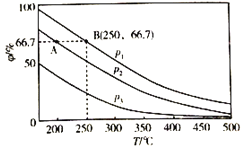
①其中,p1,p2和p3由大到小的顺序是_______,其原因是_______。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)_______vB(N2)(填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_______Pa(分压=总压×物质的量分数,保留一位小数)。
【答案】高温 +247.1 p1>p2>p3 增大压强化学平衡向正反应方向移动,故平衡混合物中氨的体积分数越大压强越大 < 8.3×103或8333.3
【解析】
I.(1)反应自发进行的条件是△H-T△S<0,结合盖斯定律分析解答;
Ⅱ.(2)①由方程式N2+3H22NH3可知,增大压强,平衡正向移动,结合图象中氨的体积分数与压强的关系分析判断;②温度越大,压强越大,反应速率越大;③根据三段式,结合平衡分压=总压×气体物质的量分数计算。
I.(1)水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+205.9kJmol-1,△H>0,△S>0,满足△H-T△S<0,则需要高温;水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+205.9kJmol-1 ①,CO(g)+H2O(g)CO2(g)+H2(g)△H2=-41.2kJmol-1 ②,二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g)△H3 ③,根据盖斯定律,将①+②得到反应③的热化学方程式:CH4(g)+CO2(g)2CO(g)+2H2(g)△H3=(+205.9kJmol-1)+(-41.2kJmol-1)=+247.1kJ/mol,故答案为:高温;+247.1;
II.(2)①由N2+3H22NH3可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为p1>p2>p3,因此压强关系是p1>p2>p3,故答案为:p1>p2>p3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;
②温度越大,压强越大,反应速率越大,p1>p2,由图可知,B对应的温度、压强大,则反应速率大,故答案为:<;
③
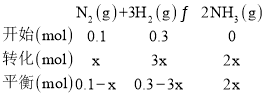
![]() =0.667,x=0.08,若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)=105Pa×
=0.667,x=0.08,若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)=105Pa×![]() =8.3×103,故答案为:8.3×103。
=8.3×103,故答案为:8.3×103。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】白藜芦醇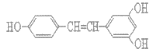 广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性。下列关于白藜芦醇的说法正确的是
广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性。下列关于白藜芦醇的说法正确的是
A. 其核磁共振氢谱共有6组峰
B. 能够跟1mol该化合物起反应的Br2或H2的最大用量分别是5mol和7mol
C. 能分别与Na2CO3溶液、FeCl3溶液、NaHCO3溶液、酸性KMnO4溶液反应
D. 所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )

A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如下图所示,下列说法中不正确的是( )
A. 在NaCl晶体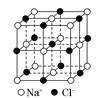 中,距Na+最近的Cl-有6个
中,距Na+最近的Cl-有6个
B. 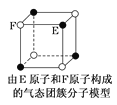 气态团簇分子的分子式为EF或FE
气态团簇分子的分子式为EF或FE
C. 在CaF2晶体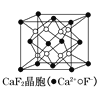 中,每个晶胞平均占有4个Ca2+
中,每个晶胞平均占有4个Ca2+
D. 在金刚石晶体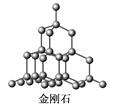 中,碳原子与碳碳键个数的比为1∶2
中,碳原子与碳碳键个数的比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案。
【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(1)设计该实验方案的目的是:探究同周期元素的__________________________。
(2)实验①的现象是 ,反应的化学方程式是 。
【实验二】 为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如下图。
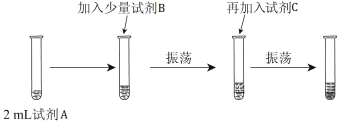
(3)试剂A是 ;试剂B是 ;试剂C是 。
(4)试剂C在实验中所起的作用是 ,加入C振荡、静置后看到的现象是: 。以上反应可以证明Cl2的非金属性_______(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于新制氯水的叙述正确的是( )
A.光照新制氯水有气泡逸出,该气体是Cl2B.新制氯水放置数天后酸性减弱
C.新制氯水中只含有Cl2和H2O两种分子D.新制氯水可使蓝色石蕊试纸先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域。一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量。下列说法正确的是
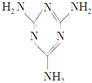
A. 三聚氰胺是一种蛋白质B. 三聚氰胺不是高分子化合物
C. 三聚氰胺分子中含有碳碳双键D. 三聚氰胺的分子式为C3H6N6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
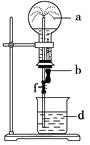
|
| |
A. |
| 水 |
B. |
| 4mol/LNaHSO3溶液 |
C. | Cl2 | 饱和NaCl水溶液 |
D. |
| 1mol/L盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒的味道主要源自于所含的辣椒素,具有消炎、镇痛、麻醉和戒毒等功效,特别是其镇痛作用与吗啡相若且比吗啡更持久。辣椒素(F)的结构简式为 ,
,
其合成路线如下:

已知:R—OH![]() R—Br
R—Br
R—Br+R′—Na→R′—R+NaBr
回答下列问题:
(1)![]() 的分子式为___________________,
的分子式为___________________,
A中所含官能团的名称是________________________,
D的最简单同系物的结构简式_______________________。
(2)A→B的反应类型为________________,
写出C→D的化学方程式:__________________________________________________。
(3)下列反应类型,辣椒素(F)不能发生的有_____________________(填序号)。
A. 加成反应 B. 取代反应 C. 氧化反应 D.消去反应 E.聚合反应
(4)写出同时符合下列三个条件的D的同分异构体的结构简式:____________________________。
①能使溴的四氯化碳溶液褪色
②能发生水解反应,产物之一为乙酸
③核磁共振氢谱为三组峰,且峰面积比为3∶2∶1
(5)4戊烯酸(CH2=CHCH2CH2COOH)可用作农药、医药中间体。参照以上合成路线,设计由CH2=CHCH2OH为起始原料制备4戊烯酸的合成路线: ________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com