
已知短周期元素的离子:aA2+、bB+、cC3﹣、dD﹣都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径 A>B>D>C B. 原子序数 d>c>b>a
C. 离子半径 C>D>B>A D. 单质的还原性 A>B>D>C
考点: 原子结构与元素周期律的关系.
分析: 已知短周期元素的离子,aA2+、bB+、cC3﹣、dD﹣ 都具有相同的电子层结构,则离子核外电子数相同,即a﹣2=b﹣1=c+3=d﹣1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属,结合元素周期律进行解答.
解答: 解:已知短周期元素的离子,aA2+、bB+、cC3﹣、dD﹣ 都具有相同的电子层结构,则离子核外电子数相同,即a﹣2=b﹣1=c+3=d﹣1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属.
A.A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,同周期,原子序数越大原子半径越小,所以原子半径B>A,C>D,电子层越大原子半径越大,所以原子半径B>A>C>D,故A错误;
B.aA2+、bB+、cC3﹣、dD﹣ 都具有相同的电子层结构,则离子核外电子数相同,即a﹣2=b﹣1=c+3=d﹣1,原子序数a>b>d>c,故B错误;
C.电子层结构相同,核电荷数越大,离子半径越小,核电荷数A>B>D>C,所以离子半径:C3﹣>D﹣>B+>A2+,故C正确;
D.A、B处于同一周期,A、B形成阳离子,则A、B为金属,原子序数A>B,单质还原性B>A,C、D处于同一周期,C、D形成阴离子,则C、D为非金属,原子序数D>C,单质氧化性D>C,故D错误.
故选C.
点评: 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,也可以确定具体的元素进行解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
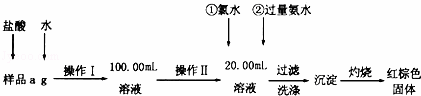
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 (填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为
(3)若不用氯水,可用下列试剂中的AC代替(填序号).
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是 .
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 ×100%(请把结果约到最简).
查看答案和解析>>
科目:高中化学 来源: 题型:
LiFePO4电视具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反应为:FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,电解质为含Li+的导电固体.下列有关LiFePO4电池说法正确的是()
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,电解质为含Li+的导电固体.下列有关LiFePO4电池说法正确的是()
A. 可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向负极移动
C. 充电过程中,电池正极材料的质量增加
D. 放电时电池正极反应为:FePO4+Li++e﹣=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
设以为阿伏伽德罗常数的值,下列叙述中正确的是( )
A. 92 g NO2和N204混合气体中含有的原子数为3NA
B. 标准状况下,11.2 L H2O中含有的电子数为20NA
C. 0.5mol•L“的Ba(0H)2溶液中0H一的数目为NA
D. 1 mol Mg与足量的02或N2反应生成MgO或Mg3N2时,失去的电子数均为2N
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是(设NA为阿伏加德罗常数的数值)( )
A. 20g重水含有10NA个电子
B. 1L 0.1 mol•L﹣1 Na2SO3溶液中含有的SO32﹣数目少于0.1NA个
C. 使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
D. 用足量铜粉除去FeCl2溶液中的FeCl3杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2Fe2++Br2═2Fe3++2Br﹣,2Fe3++2I﹣═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
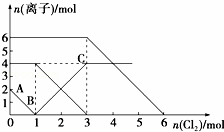
A. 还原性:I﹣>Fe2+>Br﹣
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
D. 原溶液中:n(Fe2+):n(I﹣):n(Br﹣)=2:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是()
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
A. 甲、乙、丙、丁 B. 乙、甲、丙、丁 C. 乙、甲、丁、丙 D. 丁、丙、乙、甲
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(x)可表示为()
A. V(NH3)=0.0010mol•L﹣1•S﹣1 B. V(O2)=0.0010 mol•L﹣1•S﹣1
C. V(NO)=0.010 mol•L﹣1•S﹣1 D. V(H2O)=0.045 mol•L﹣1•S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A有稳定性好、抗氧化能力强的特点,其结构如图 .分子中片段X对A的性能起了重要作用,为研究X的结构,将化合物A在一定条件下水解只得到B(
.分子中片段X对A的性能起了重要作用,为研究X的结构,将化合物A在一定条件下水解只得到B(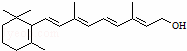 )和C.经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生
)和C.经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生
完成下列填空:
(1)化合物B能发生下列哪种类型的反应
a.取代反应b.加成反应c.缩聚反应d.氧化反应
(2)化合物C能经下列反应得到G(分子式为C8H6O2,分子内含五元环).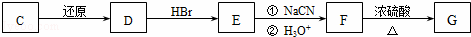
已知:ROOH RCH2OH RX
RCH2OH RX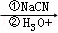 RCOOH
RCOOH
化合物C的结构简式为 .
(3)反应F→G的化学方程式为
(4)化合物E有多种同分异构体,1H核磁共振谱图表明,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体中任意三种的结构简式、、.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com