
【题目】化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是( )
A. 干冰升华B. 酸碱中和
C. 天然气燃烧D. Ba(OH)28H2O晶体与NH4Cl晶体混合并搅拌
科目:高中化学 来源: 题型:
【题目】丁酮酸乙酯( )和聚乙烯醇(PVA)都是重要的有机化工产品,其合成路线如图所示。
)和聚乙烯醇(PVA)都是重要的有机化工产品,其合成路线如图所示。

已知:①A是同系物中最小的直线形分子,且核磁共振氢谱显示其只有一种化学环境的氢;F为高聚物。
②![]() 不稳定会自动转化为RCH2CHO。
不稳定会自动转化为RCH2CHO。

回答下列问题:
(1)A中所含官能团是___________(填名称),B的结构简式为___________。
(2)E的名称为___________。
(3)写出反应⑥的化学方程式:____________________,该反应的反应类型为___________。
(4)由D制丁酮酸乙酯的反应产物中还有乙醇,制备过程中要加人适量的金属钠,其作用是______________________。(根据化学方程式和平衡移动原理回答)
(5)符合下列条件的丁酮酸乙酯的同分异构体有___________种。
a.能发生银镜反应 b.能与Na2CO3溶液反应放出气体
其中核磁共振氢谱显示为4组峰,且峰面积之比为1︰1︰2︰6的是___________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有可逆反应2NO2(g) ![]() N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。
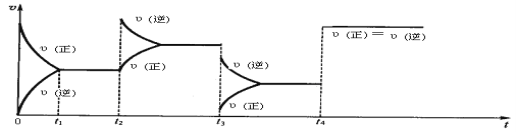
t2:___________________;t3:______________________ ;t4:______________________。
已知:A(g) + 2B(g) ![]() 2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
K值会______(增大、减小、不变),A的转化率______________,化学反应速率________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是___________。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)= CO2(g)+CaO(s) △H=+178.2kJ/mol
SO2(g)+CaO(s)= CaSO3(s) △H=-402kJ/mol
2CaSO3(s)+O2(g )= 2CaSO4(s) △H=-234.2kJ/mol
写出石灰石脱硫的热化学反应方程式___________________________。
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol
N2(g)+CO2(g) △H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H=-64.2kJ/mol
N2(g)+2CO2(g) △H=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:

①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C适当缩小容器的体积 D.加入合适的催化剂
(4)某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________;在1100kPa时,NO2的体积分数为___________。

(5)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求回答问题:


(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置的字母,下同)
(2)从油水混合物中分离出植物油,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,水的方向是从________口进水_______口出水。
(4)装置B在分液时打开活塞后,下层液体从________,上层液体从________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾的流程如下:

(1)“制酸”过程中生成磷酸的化学方程式为___________________________________________________。
该过程若用硫酸代替盐酸,磷酸的产率明显降低,其原因是___________________________________。
(2)“反应”中加入有机碱——三辛胺(TOA)的目的是____________________________________________。
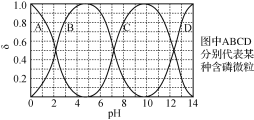
(3)“反应”中,三辛胺的用量会影响溶液的pH。水溶液中H3PO4、H2PO4-、HPO42-、PO43-的分布分数δ随pH的变化如右图所示。
①“反应”中,当pH=____时,停止加入三辛胺。
②使用pH试纸测定溶液pH的操作是_____________________________________________。
(4)查阅资料可知:①磷酸三丁酯、二(2乙基己基)磷酸都是难溶于水的液态有机物。
②磷酸三丁酯对H3PO4和Fe3+有较强的萃取作用。
③二(2乙基己基)磷酸仅对Fe3+有较强的萃取作用。
请根据题中信息,补充完整“提纯”步骤的实验方案:向“制酸”所得粗磷酸中加入活性炭,________________,向有机层中加入蒸馏水,振荡、静置,分液取水层,得到稀磷酸。[实验中须使用的试剂有:二(2乙基己基)磷酸、磷酸三丁酯]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间发生的化学反应属于吸热反应的是( )
A. 木炭和氧气B. 生石灰和水C. 盐酸和氢氧化钠溶液D. NH4Cl晶体和Ba(OH)28H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室需要0.1 mol·L1NaOH溶液500 mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________________。

(2)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;
④使用之前要检查是否漏水。这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______g。
Ⅱ.配制1 mol/L的稀硫酸溶液500 mL。回答下列问题。
(5)需要质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_________mL(计算结果保留一位小数)。如果实验室有25 mL、50 mL、10 0mL量筒,应选用________mL规格的量筒最好。
(6)下面操作造成所配稀硫酸溶液浓度偏高的是______(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B. Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量) ![]() TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com