
| A | B | C | D | |
| 装置 |  |  |  |  |
| 实验 | 从KI和I2的固体混合物中回收I2 | 分离混合体系中的Fe(OH)3沉淀和胶体 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离苯酚和水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碘易升华,KI固体不能;
B.Fe(OH)3沉淀不能透过滤纸;
C.蒸干时氯化铵分解;
D.苯酚与水分层.
解答 解:A.碘易升华,KI固体不能,则利用图中装置分离出碘时,在蒸发皿的上方应利用玻璃片收集碘,故A错误;
B.Fe(OH)3沉淀不能透过滤纸,能利用图中过滤装置分离,故B正确;
C.蒸干时氯化铵分解,不能利用蒸发得到氯化铵,应选择冷却结晶法,故C错误;
D.苯酚与水分层,能利用图中分液装置分离,故D正确;
故选BD.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意分离方法及实验装置,注重元素化合物与实验相结合的训练,题目难度不大.


科目:高中化学 来源: 题型:选择题
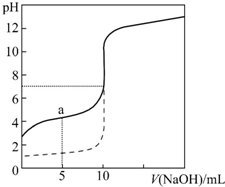 常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )
常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )| A. | 图中虚线表示NaOH溶液滴定盐酸时的pH变化 | |
| B. | 酸溶液的体积均为10 mL | |
| C. | a点:c(CH3COO-)>c(CH3COOH) | |
| D. | 当pH=7时,滴定醋酸消耗的V(NaOH)=10 mL,且c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙干燥氨气 | |
| C. | 用装置丙除去甲烷中混有的乙烯 | |
| D. | 利用装置丁制取硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
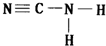 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的结构简式为HCOOCH2CH3 | B. | Y的分子中不含-CH3(甲基) | ||
| C. | Z不具有氧化性 | D. | Z分子中含有甲基且具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “元质”即现代之“元素”,现在人类发现的化学元素多于六十四种 | |
| B. | “养、轻、淡”即“氧、氢、氮”三种元素,现代的元素命名更具科学性 | |
| C. | 上文提到的八种“元质”包括四种金属“元质”和四种非金属“元质” | |
| D. | “微渺”因极其微小,故“微渺”是组成物质的基本微粒,不可再分 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
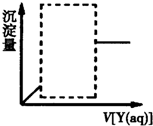 X、Y是浓度均为0.1mol•L-1的下列溶液中的某一种:①MgSO4溶液②Al2(SO4)3溶液③Ba(OH)2溶液④NaOH溶液.现向溶液X中逐滴加入溶液Y,得到的沉淀量与所加Y溶液的体积关系如图所示(图中虚线框内曲线已省略),则符合该图象的X、Y的组合共有( )
X、Y是浓度均为0.1mol•L-1的下列溶液中的某一种:①MgSO4溶液②Al2(SO4)3溶液③Ba(OH)2溶液④NaOH溶液.现向溶液X中逐滴加入溶液Y,得到的沉淀量与所加Y溶液的体积关系如图所示(图中虚线框内曲线已省略),则符合该图象的X、Y的组合共有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵增加且放热的反应一定能自发进行 | |
| B. | 若可逆反应正、逆反应速率改变,则化学平衡一定发生移动 | |
| C. | 放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应 | |
| D. | 若某化学平衡发生移动,则平衡混合体系的压强一定发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com