



| ||
| △ |
| ||
| △ |
| ||


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
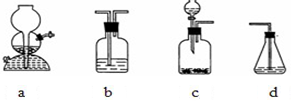 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.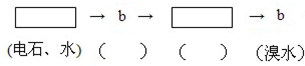
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取液体时,视线与量筒内液体凹液面最低处保持水平 |
| B、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并搅拌 |
| C、用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁 |
| D、用托盘天平称量物质时,称量物放在左盘,砝码放在右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.04 g |
| B、8.26 g |
| C、8.51 g |
| D、9.02 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的名称是
的名称是 的分子式是
的分子式是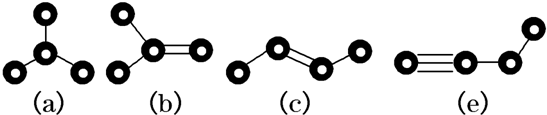
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO4(s) |
| B、H2O |
| C、K2SO4溶液 |
| D、4mol/L H2SO4? |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知可逆反应:mA(g)+nB(1)?pC(g).改变温度(其他条件不变)、压强(其他条件不变)对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )
已知可逆反应:mA(g)+nB(1)?pC(g).改变温度(其他条件不变)、压强(其他条件不变)对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )| A、m>p,正反应为放热反应 |
| B、m<p,正反应为吸热反应 |
| C、m+n<p,正反应为放热反应 |
| D、m+n<p,正反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com