
物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能实现的是( )。
| 选项 | 转化关系 |
| A | Si |
| B | NO2 |
| C | Fe |
| D | S |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
实验室利用电石渣(主要含CaO、CaC2及少量C、SiO2)为原料制备氯酸钾的实验流程及相关物质的溶解度如下:
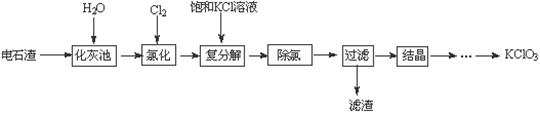
| 几种物质溶解度与温度的关系 | |||||
| 温度 | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
(1) 化灰池中CaC2与水反应的化学方程式为 。
(2)在80℃氯化时产生氯酸钙及氯化钙的化学方程式为 ;除去溶液中多余的氯气的简单方法是 。
(3)饱和KCl溶液能与氯酸钙反应的原因是 。
(4)滤渣中的成分主要是 (写化学式);从过滤后的溶液中获得KClO3晶体的方法是 、 、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质应用和组成的说法正确的是
A.P2O5可用于干燥C12和NH3 B.“可燃冰”主要成分是甲烷和水
C.CC14 可用于鉴别溴水和碘水 D.Si和SiO2都用于制造光导纤维
可用于鉴别溴水和碘水 D.Si和SiO2都用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2 在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=== 6CaO(s)+P4(s)+10CO(g) △H1 =+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=== CaSiO3(s) △H2 =-89. 61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=== 6CaSiO3(s)+P4(s)+10CO(g) △H3
则△H3 = kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=== 20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示。

①为获得尽可能纯的NaH2PO4,pH应控制在 ;pH=8时,溶液中主要含磷物种浓度大小关系为 。
②Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇(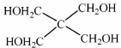 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。

①酸性气体是 (填化学式)。
②X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
40.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
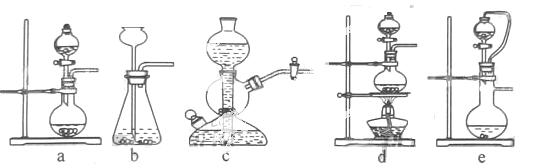
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 (填写字母)。
41.若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠
g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g (保留一位小数)。
42.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
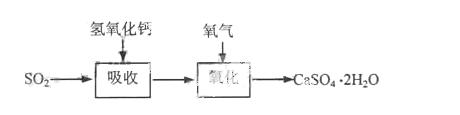
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
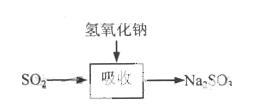
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 。和碱法相比,石灰-石膏法的优点是 ,缺点是 。
43.在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl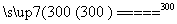 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_____________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点-33 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下图(热源及夹持装置略去)

①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________________________。
装置D中发生反应的化学方程式为_____________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是(填写字母代号)________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图所示的装置进行实验:

(1)实验开始一段时间后,可观察到锥形瓶瓶口上方有白烟生成,请补充可能观察到的其他现象:______________________________________________;
有关化学方程式为__________________________________________________。
(2)由于气温的原因,上述实验一段时间后现象不太明显,需要向锥形瓶内加入下列哪种物质才能重新看到明显的现象?________。
A.NaOH B.CaO
C.浓H2SO4 D.NH4Cl
(3)经过对比实验证明,在其他条件相同时,用空气代替氧气的实验效果较差,主要原因是________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在铁和氧化铁的混合物15 g中加入150 mL稀H2SO4放出氢气1.68 L(标准状况下)。当反应停止后,铁与氧化铁均无剩余,且溶液中没有Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol·L-1NaOH溶液200 mL。
(1)写出溶液中反应的化学方程式:
_____________________________________________________;
_____________________________________________________;
_____________________________________________________。
(2)混合物中铁的质量为________,氧化铁的质量为________。
(3)稀H2SO4的物质的量浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com