
| A. | NO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色 | |
| B. | MgO、Al2O3都是高熔点离子化合物,都能用作耐热材料 | |
| C. | CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | CuO、Fe2O3都是不溶于水的碱性氧化物,都是黑色粉末 |
分析 A.NO2不是酸性氧化物,与高锰酸钾不反应;
B.熔点高的物质,可作耐火材料;
C.CO2由分子构成,由SiO2原子构成;
D.Fe2O3为红棕色.
解答 解:A.NO2不是酸性氧化物,与高锰酸钾不反应,而SO2是酸性氧化物,能使酸性高锰酸钾溶液褪色,故A错误;
B.熔点高的物质,可作耐火材料,则MgO、Al2O3都是高熔点离子化合物,都能用作耐热材料,故B正确;
C.CO2由分子构成,由SiO2原子构成,二者物理性质不同,故C错误;
D.Fe2O3为红棕色,CuO为黑色,CuO、Fe2O3都是不溶于水的碱性氧化物,故D错误;
故选B.
点评 本题考查物质的性质,侧重于学生的分析能力的考查,为高考常见题型,把握物质的性质及发生的反应为解答的关键,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | OH- | C. | Cl- | D. | S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ④⑤⑥⑦ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cr2O72-、SO42- | B. | Na+、OH-、SO42-、HCO3- | ||
| C. | K+、Mg2+、SO42-、OH- | D. | H+、K+、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
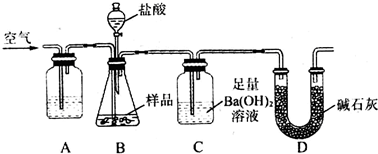
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子半径:K+>Cl->Na+>F- | B. | 酸性:H2SO4>H3PO4>H2CO3>H2SiO3 | ||
| C. | 熔点:石英>食盐>钾>干冰 | D. | 还原性:NaCl>NaBr>NaI>Na2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com