
【题目】反应Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为K=![]()
C. 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D. 该反应的正反应是放热反应
【答案】C
【解析】
A.升高温度,正、逆反应速率都增大;
B.固体物质的浓度是定值,在平衡常数表达式中不出现固体物质的浓度;
C. 绝热容器中进行的反应,温度不再变化,反应达到平衡状态;
D.根据题给K值可知,温度升高,K值增大,该反应的正反应是吸热反应;
由题意可知,升高温度平衡常数变大,说明该反应正方向为吸热反应。
A项,升高温度,正逆反应速率都增大,故A项错误;
B项,反应过程中,固体物质的浓度不发生变化,所以平衡常数表达式中,不应该写固体,故B项错误;
C项,反应过程中,伴随着能量变化,温度不变时,说明正逆反应速率相等,反应达到平衡,故C项正确;
D项,温度升高,平衡常数增大,平衡右移,说明正反应是吸热反应,故D项错误。
正确选项C。


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.锌锰干电池中,锰是正极,锌是负极
C.甲醇燃料电池可把化学能转化为电能
D.铅蓄电池中,正极板上覆盖的是PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲苯合成苯甲醛:
 ,
,
下列说法正确的是
A. 甲苯分子中所有原子都在同一平面内 B. 反应①②③的反应类型相同
C. 一氯甲苯的同分异构体有3种 D. 苯甲醇可与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅与氢氧化钠溶液反应(Si+2NaOH+H2O=Na2SiO3+2H2↑)的说法正确的是( )
A.氧化剂是NaOH和H2OB.氧化剂是H2O
C.氧化剂是SiD.还原剂是H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血液中的血红蛋白和肌肉中的肌动蛋白的结构和功能不同的原因最正确的是
A. 两种蛋白质所含氨基酸的数目不同
B. 两种蛋白质所含肽链的空间结构不同
C. 两种蛋白质所含氨基酸的排列顺序不同
D. 两种蛋白质所含氨基酸的种类、数目、排列顺序和肽链的空间结构有差别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:

(1)该反应为____反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是____(填字母)。
A.改铁片为铁粉 B.滴加少量CuSO4 溶液
C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_______极(填“正”或“负”)。铜片上产生的现象为________,该极上发生的电极反应为_______。2min后铁片的质量减少1.4 g,则导线中流过的电子为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是当今世界上困扰人类发展的重大问题之一,下利能量转化不正确的是
A.电炉取暖是将电能转化为热能
B.酒精燃烧是将化学能转化热能
C.太阳能发电是将化学能转化为电能
D.手机充电是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,下列有关说法不正确的是
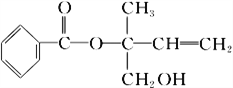
A. X分子中含有三种官能团
B. 可用酸性高锰酸钾溶液区别苯和X
C. X在一定条件下能发生加成、加聚、取代、氧化等反应
D. 在催化剂的作用下,1 mol X最多能与5 mol H2加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com