

分析 根据元素所在周期表中的位置可知a为H元素,b为Na元素,c为Al元素,d为C元素,e为Si元素,f为N元素,g为O元素,h为Cl元素,结合元素周期律的递变规律以及对应物质的性质进行分析,
(1)g与a可形成化合物a2g为Na2O2,过氧根离子内部有非极性键,钠离子与过氧根离子之间有离子键;
(2)根据元素周期律,元素非金属性越强,氢化物稳定性越强;
(3)氧化铝能与盐酸反应,而二氧化硅不溶于盐酸,据此可以分离提纯二氧化硅;
(4)乙烯与水会发生加成反应生成乙醇;
(5)在氢氧燃料电池中,氢气是还原剂,氧气是氧化剂,氢气与氧气反应生成水.
解答 解:根据元素所在周期表中的位置可知a为H元素,b为Na元素,c为Al元素,d为C元素,e为Si元素,f为N元素,g为O元素,h为Cl元素,
(1)g为O元素,a为H元素,g与a可形成化合物a2g为Na2O2,含有的化学键类型有离子键、非极性键,
故答案为:离子键、非极性键;
(2)e、f、g三种元素气态氢化物为:SiH4、NH3、H2O,非金属性越强,对应的氢化物越稳定,非金属性Si<N<O,故稳定性SiH4<NH3<H2O,
故答案为:SiH4<NH3<H2O;
(3)从化合物Al2O3与SiO2组成的混合物中分离提纯SiO2,可在混合物中加入盐酸,再过滤洗涤,
故答案为:H、Cl;
(4)a为H元素,d为C元素,a、d两种元素可形成多种化合物,其中化合物X的产量是衡量一个国家石油化工发展水平的标志,X为CH2=CH2,X与H2O在一定条件下反应生成化合物A为乙醇,反应的化学方程式为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;
(5)航天技术中常使用氢气和氧气组成的燃料电池,电池反应为2H2+O2═2H2O,故答案为:2H2+O2═2H2O.
点评 本题考查位置结构性质的相互关系及应用,题目难度不大,本题关键为正确把握元素在周期表中的位置,要求学生熟悉元素周期表.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:解答题
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
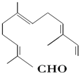 现有试剂:
现有试剂:| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 氢化物的沸点为H2T>H2R | |
| D. | 单质与浓度相等的稀盐酸反应的剧烈程度为Q>L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  NaOH溶液 | B. |  稀硫酸 | C. |  稀硝酸 | D. |  稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
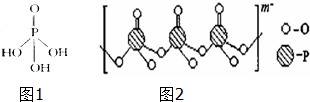 磷单质及其化合物在工业生产巾有着广泛的应用.向磷可用于制备高纯度的磷酸(磷酸结构简式如图1),三聚磷酸钠是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
磷单质及其化合物在工业生产巾有着广泛的应用.向磷可用于制备高纯度的磷酸(磷酸结构简式如图1),三聚磷酸钠是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com