
【题目】钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
(1)钛有 ![]() Ti和
Ti和 ![]() Ti两种原子,其基态原子的电子排布式为;按电子排布Ti元素在元素周期表分区中属于区元素.
Ti两种原子,其基态原子的电子排布式为;按电子排布Ti元素在元素周期表分区中属于区元素.
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如图1所示,它的化学式是 . 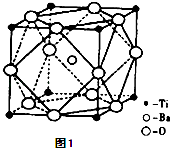
(3)氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金装饰的替代品.以TiCl4为原料,经过一系列反应,可以制得Ti3N4和纳米TiO2 . 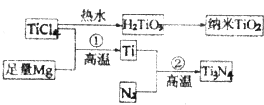
①TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为 . ②纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下: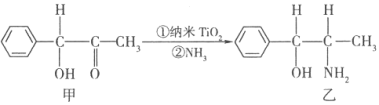
化合物甲的分子中采取sp2杂化的碳原子个数为 , 化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为 .
③另有一种氮化钛晶体的晶胞如图2所示,该氮化钛晶胞中含有个N原子,晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为 gcm﹣3(用NA表示阿伏加德罗常数的数值,只列算式).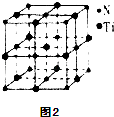
【答案】
(1)1s22s22p63s23p63d24s2;d
(2)BaTiO3
(3)正四面体;7;O>N>C;4;![]()
【解析】解:(1)根据 ![]() Ti可知,钛为22号元素,所以它电子排布式为:1s22s22p63s23p63d24s2 , 它在元素周期表的第四周期第ⅡB族,所以是d区元素,所以答案是:1s22s22p63s23p63d24s2; d;(2)利用均摊法可知Ti的原子个数为:8×
Ti可知,钛为22号元素,所以它电子排布式为:1s22s22p63s23p63d24s2 , 它在元素周期表的第四周期第ⅡB族,所以是d区元素,所以答案是:1s22s22p63s23p63d24s2; d;(2)利用均摊法可知Ti的原子个数为:8× ![]() =1,Ba的原子个数为:1,O的原子个数为:12×
=1,Ba的原子个数为:1,O的原子个数为:12× ![]() =3,所以晶体的化学式为:BaTiO3 , 所以答案是:BaTiO3;(3))①、TiCl4分子中4个氯原子不在同一平面上,可知Ti原子的杂化方式为sp3,所以分子的空间构型为正四面体,所以答案是:正四面体;②化合物甲的分子中采取sp2杂化的碳原子有苯环上的六个各羰基中的一个,共7个,根据化合物乙的结构可知sp3杂化的原子有羟基中的氧、氨基中的氮、碳链上的三个碳,它们都位于第二周期,C、N、O 原子序数依次增加,根据元素周期律,同周期元素随着原子序数依次增加电负性逐渐增大,所以它们的电负性关系为:O>N>C,所以答案是:7; O>N>C;③根据均摊法可算出该晶胞中N原子个数为:6×
=3,所以晶体的化学式为:BaTiO3 , 所以答案是:BaTiO3;(3))①、TiCl4分子中4个氯原子不在同一平面上,可知Ti原子的杂化方式为sp3,所以分子的空间构型为正四面体,所以答案是:正四面体;②化合物甲的分子中采取sp2杂化的碳原子有苯环上的六个各羰基中的一个,共7个,根据化合物乙的结构可知sp3杂化的原子有羟基中的氧、氨基中的氮、碳链上的三个碳,它们都位于第二周期,C、N、O 原子序数依次增加,根据元素周期律,同周期元素随着原子序数依次增加电负性逐渐增大,所以它们的电负性关系为:O>N>C,所以答案是:7; O>N>C;③根据均摊法可算出该晶胞中N原子个数为:6× ![]() +8×
+8× ![]() =4,该晶胞中Ti原子个数为:1+12×
=4,该晶胞中Ti原子个数为:1+12× ![]() =4,∴晶胞的质量m=
=4,∴晶胞的质量m= ![]() ,而晶胞的体积V=(2a×10﹣10)3cm3 , 所以晶体的密度ρ=
,而晶胞的体积V=(2a×10﹣10)3cm3 , 所以晶体的密度ρ= ![]() =
= ![]() gcm﹣3 , 所以答案是:4=
gcm﹣3 , 所以答案是:4= ![]() .
.


科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的区别,叙述正确的是
A. 胶体带电荷,溶液不带电荷
B. 一束光线通过溶液时没有明显现象,而通过胶体时会出现明显的光路
C. 溶液中分散质可通过滤纸,胶体中分散质不能通过滤纸
D. 溶液长时间静置易产生浑浊,胶体长时间静置不产生浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用.下图是生产亚氯酸钠的工艺流程图: 
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O;
②常温下,Ksp(FeS)=6.3×10﹣18;Ksp(CuS)=6.3×10﹣36;Ksp(PbS)=8×10﹣28
③Ⅲ装置中电解硫酸钠溶液,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠.
(1)I中发生反应的离子方程式为 .
(2)从滤液中得到NaClO23H2O晶体的所需操作依次是(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/molL﹣1 | 1×10﹣2 | 6.3×10﹣4 | K1=4.30×10﹣7 | K1=9.1×10﹣8 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为(用化学式表示);
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;常温下,当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1)此时体系中的S2﹣的浓度为 .
(4)Ⅲ装置中若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是( )
A.1 mol乙醇燃烧生成3 mol水
B.1 mol乙醇可以生成1 mol乙醛
C.1 mol乙醇跟足量的金属钠作用得0.5 mol氢气
D.乙醇的分子式为C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式是: 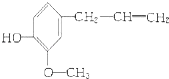 该物质不应有的化学性质是( ) ①可以燃烧
该物质不应有的化学性质是( ) ①可以燃烧
②可以跟溴加成
③可以将KMnO4酸性溶液还原
④可以跟NaHCO3溶液反应
⑤可以跟NaOH溶液反应
⑥可以发生消去反应.
A.①③
B.③⑥
C.④⑥
D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列关于pH=3的CH3COOH溶液和pH=3的HCl溶液的叙述中不正确的是
A. 两种溶液中溶质的物质的量浓度:CH3COOH>HCl
B. 向CH3COOH溶液中通入HCl(g), 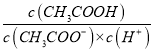 的值不变
的值不变
C. 均与pH=11的氨水混合,使溶液显中性,两溶液的导电性相同,水的电离程度也相同
D. 在CH3COONa溶液中分别加入等量的上述两种溶液,溶液中的c(Na+)/c(CH3COO-)前者减小,后者增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写及解释均正确的是
A. 0.1mol/L 的 Na2S溶液中 c(S2-)<0.1mol/L 的原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B. 实验室制备氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
C. 水中加入NaOH:H2O+H2O![]() H3O++OH-加入NaOH,消耗溶液中的H3O+平衡右移
H3O++OH-加入NaOH,消耗溶液中的H3O+平衡右移
D. 在碳酸钠溶液中通入CO2气体,CO32-+H2O![]() HCO3-+OH-,CO2 消耗OH- 促使平衡正向移动
HCO3-+OH-,CO2 消耗OH- 促使平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一化学平衡:mA(g)+nB(g)pC(g)+qD(g).如图表示的是A的转化率与压强、温度T的关系.分析图中曲线可以得出的结论是( ) 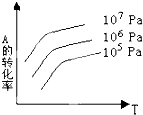
A.正反应吸热,m+n>p+q
B.正反应吸热,m+n<p+q
C.正反应放热,m+n>p+q
D.正反应放热,m+n<p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃1mol 恰好与1molHCl加成,生成物分子中的氢又可被5molCl2完全取代,则此气态烃可能是( )
A. C4H10 B. C2H4 C. CH2=CH—CH3 D. CH2=C(CH3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com